-
世界第一条大面积碲化镉薄膜“发电玻璃”生产线最近在成都投产,该材料是在玻璃表面镀一层碲化镉薄膜,光电转化率高。下列说法错误的是
A. 普通玻璃含有二氧化硅 B. 该发电玻璃能将光能完全转化为电能
C. 碲化镉是一种无机化合物 D. 应用该光电转化技术可减少温室气体排放
难度: 简单查看答案及解析
-
下列关于有机物的说法正确的是
A. C5H10O2的同分异构体中,能与NaHCO3反应生成CO2的有4种
B. 糖类、油脂、蛋白质都是电解质
C. 乙烯使溴水、酸性高锰钾溶液褪色的反应类型相同
D. 将碘酒滴到未成熟的苹果肉上变蓝说明苹果肉中淀粉已水解
难度: 中等查看答案及解析
-
X、Y、Z、W为原子序数依次增大的短周期主族元素。X分别与Y、Z、W结合形成质子数相同的甲、乙、丙三种分子。丁为无色气体,遇空气变红棕色;丙的水溶液可刻蚀玻璃。
上述物质有如图转化关系:
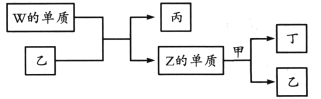
下列说法错误的是
A. 四种元素形成的单质中W的氧化性最强
B. 甲、乙、丙中沸点最高的是丙
C. 甲常用作致冷剂
D. 甲、乙分子均只含极性共价键
难度: 中等查看答案及解析
-
用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
难度: 中等查看答案及解析
-
25℃将浓度均为0.1 mol/L的HA溶液和BOH溶液按体积分别为Va和Vb混合,保持Va+Vb=100 mL,且生成的BA可溶于水。已知Va、Vb与混合液pH关系如图。下列说法错误的是
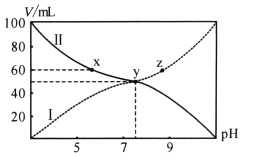
A. 曲线II表示HA溶液体积
B. x点存在c(A-)+c(OH-)=c(B+)+c(H+)
C. 电离平衡常数K(HA)>K(BOH)
D. 向z点溶液加入NaOH,水的电离程度减小
难度: 困难查看答案及解析
-
下列实验中,与现象对应的结论一定正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知某高能锂离子电池的总反应为:2Li+FeS= Fe +Li2S,电解液为含LiPF6.SO(CH3)2的有机溶液(Li+可自由通过)。某小组以该电池为电源电解废水并获得单质镍,工作原理如图所示。
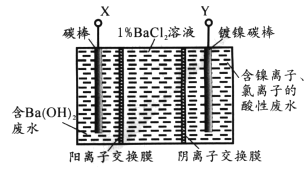
下列分析正确的是
A. 该锂离子电池正极反应为FeS+2Li++2e-=Fe +Li2S
B. X与电池的Li电极相连
C. 电解过程中c(BaC12)保持不变
D. 若去掉阳离子膜将左右两室合并,则X电极的反应不变
难度: 中等查看答案及解析






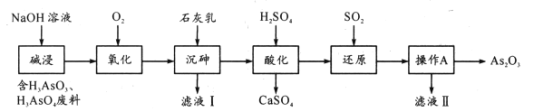
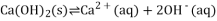
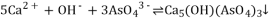
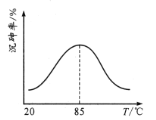
 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

 分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应,消耗NaOH、NaHCO3的物质的量之比为____;检验 其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。
其中一种官能团的方法是____(写出官能团名称、对应试剂及现象)。