-
天然气因含有少量H2S等气体开采应用受限。T.F菌在酸性溶液中可实现天然气的催化脱硫,其原理如图所示。下列说法不正确的是

A. 该脱硫过程需要不断添加Fe2(SO4)3溶液
B. 脱硫过程O2间接氧化H2S
C. 亚铁是血红蛋白重要组成成分,FeSO4可用于治疗缺铁性贫血
D. 《华阳国志》记载“取井火煮之,一斛水得五斗盐”,我国古代已利用天然气煮盐
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述中正确的是
A. l00g 9%的葡萄糖水溶液中氧原子数为0.3 NA
B. 标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C. 工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
D. 常温下l LpH=7的1mol/LCH3COONH4溶液中CH3COO-与NH4+数目均为NA
难度: 中等查看答案及解析
-
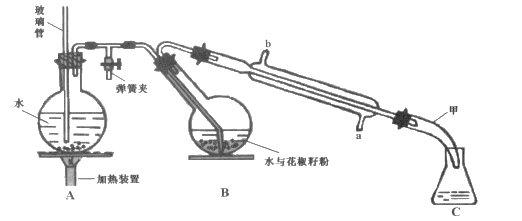
实验室常用如下装置制备乙酸乙酯。下列有关分析不正确的是

A. b中导管不能插入液面下,否则会阻碍产物的导出
B. 固体酒精是一种白色凝胶状纯净物,常用于餐馆或野外就餐
C. 乙酸乙酯与
互为同分异构体
D. 乙酸、水、乙醇羟基氢的活泼性依次减弱
难度: 中等查看答案及解析
-
前20号元素X、Y、Z、W、R原子序数依次增大。其中X、Z、R最外层电子数相等, 且X与Z、R均可形成离子化合物;Y、W同主族,Y最外层电子数是内层电子数的3倍。下列说法正确的是
A. 元素原子半径大小顺序为:W>Z>Y
B. X分别与Y、Z、W形成的常见化合物都属于电解质
C. Y分别与Z、R形成的化合物中均只含有离子键
D. Y分别与X、Z、W均可形成具有漂白性的化合物,且漂白原理相同
难度: 中等查看答案及解析
-
2019年3月,我国科学家研发出一种新型的锌碘单液流电池,其原理如图所示。下列说法不正确的是
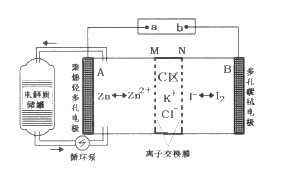
A. 放电时B电极反应式为:I2+2e-=2I-
B. 放电时电解质储罐中离子总浓度增大
C. M为阳离子交换膜,N为阴离子交换膜
D. 充电时,A极增重65g时,C区增加离子数为4NA
难度: 中等查看答案及解析
-
在硫酸铜晶体结晶水含量测定的实验过程中,下列仪器或操作未涉及的是
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
苹果酸(H2MA,Ka1=1.4×10-3;Ka2=1.7×10-5)是一种安全的食品保鲜剂,H2MA分子比离子更易透过细胞膜而杀灭细菌。常温下,向20 mL 0.2 mol/L H2MA溶液中滴加0.2mol/L NaOH溶液。根据图示判断,下列说法正确的是

A. b点比a点杀菌能力强
B. 曲线Ⅲ代表HMA-物质的量的变化
C. MA2-水解常数Kh≈7.14×10-12
D. 当V=30 mL时,溶液显酸性
难度: 中等查看答案及解析
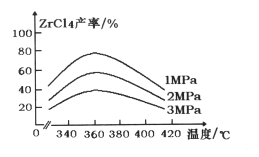
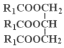 表示)
表示)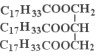 计,式量:884)。
计,式量:884)。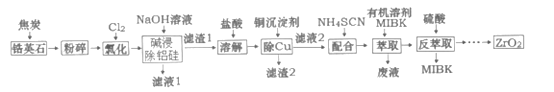




 的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
的路线为____(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。