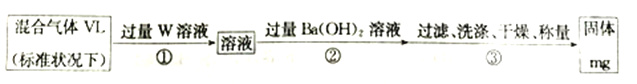-
二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
| 物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
| 剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ |
| 化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 2SCl2 2SCl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 |
(1)制取少量S2Cl2
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。
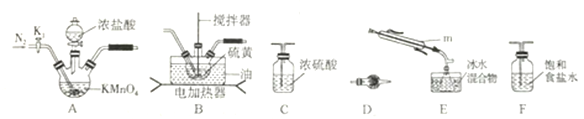
①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A ______
______

 E
E D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。
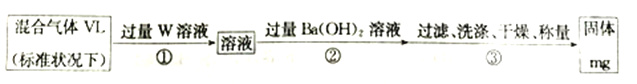
①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。
-
在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)短周期中可以做半导体材料的元素的最高价氧化物与烧碱溶液反应的离子方程式是:__________;
(2)为了提高煤的利用率,常将其气化或液化,其中一种液化是将气化得到的氢气和一氧化碳在催化剂作用下转化为甲醇,写出该化学反应方程式为____________;
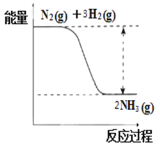
(3)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是________反应(填“吸热”或“放热”)。
②在一定条件下,将2.5mol N2和7.5mol H2的混合气体充入体积为2L的固定闭容器中发生反应:N2(g)+ 3H2(g)  2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
2NH3(g),5分钟末时达到平衡,测得容器内的压强是开始时的0.9倍,则5分钟内用氨气表示该反应的平均化学反应速率为:V(NH3)=____________;氢气达到平衡时的转化率是_____________(保留小数点后一位);
(4)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图所示:
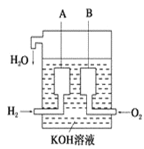
A,B两个电极均由多孔的碳块组成。该电池的正极反应式为:________________;若将上述装置中的氢气换成甲烷,其余都不改变,对应装置的负极反应方程式为_________________。
-
已知:有机物A的产量可以用来衡量一个国家的石油化工发展水平。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

(1)B分子中官能团的名称是____,D中官能团的名称是____;反应①的反应类型是_____反应。
(2)反应②的化学方程式是_____,反应⑤的化学方程式是______。
(3)①某同学用如图所示的实验装置制取少量乙酸乙酯。实验结束后,试管甲中上层为透明的、不溶于水的油状液体。上述实验中试管甲中试剂为______,其作用是_____(填字母)。

A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
②在实验室利用B和D制备乙酸乙酯的实验中,若用1 mol B和1 mol D充分反应,____(填“能”或“不能”)生成1 mol 乙酸乙酯,原因是______。
-
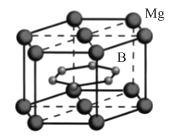
FeSe、MgB2等超导材料具有广阔的应用前景。
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为________,基态Se原子的电子占据最高能级的电子云轮廓图为________形。
(2)向FeSe中嵌入吡啶( )能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
)能得到具有优异性能的超导材料。吡啶中氮原子的杂化类型为________;该分子内存在________(填标号)。
A.σ键 B.π键 C.配位键 D.氢键
(3)将金属锂直接溶于液氨,得到具有很高反应活性的金属电子溶液,再通过系列反应可制得FeSe基超导材料Li0.6(NH2)0.2(NH3)0.8Fe2Se2。
①NH2-的空间构型为________。
②液氨是氨气液化的产物,氨气易液化的原因是________。
③金属锂溶于液氨时发生反应:Li + (m+n)NH3=X+e-(NH3)n。X的化学式为________。
(4)MgB2晶体结构如图所示。B原子独立为一层,具有类似于石墨的结构,每个B原子周围都有________个与之等距离且最近的B原子;六棱柱底边边长为a cm,高为c cm,阿伏加德罗常数的值为NA ,该晶体的密度为________ g·cm-3(列出计算式)。
-
为应对全球石油资源日益紧缺,提高煤的利用效率,我国开发了煤制烯烃技术,并进入工业化试验阶段。
(1)煤气化制合成气(CO和H2):
 该反应在高温下能自发进行,理由是_____。
该反应在高温下能自发进行,理由是_____。
(2)由合成气制甲醇:合成气CO和H2在一定条件下能发生如下反应:主反应Ⅰ. ,副反应Ⅱ.
,副反应Ⅱ. 。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)
。某实验室控制反应温度为400℃,在相同的反应体系中分别填装等量的两种催化剂(Cat.1和Cat.2),以恒定的流速通入CH3OH,在相同的压强下进行两种催化剂上甲醇制烯烃的对比研究。得到如图实验数据:(选择性:转化的甲醇中生成乙烯和丙烯的百分比)



下列说法不正确的是______。
A. 反应进行一段时间后甲醇的转化率减小,可能的原因是催化剂失活,工业生产中需定期更换催化剂
B. 使用Cat.2反应2h后乙烯和丙烯的选择性下降,可能的原因是生成副产物二甲醚
C. 使用Cat.1产生的烯烃主要为丙烯,使用Cat.2产生的烯烃主要为乙烯
D. 不管使用Cat.1还是使用Cat2,都能提高活化分子的百分数
(3)已知: 。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
。以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:

①a为电源的______(填“正极”或“负极”);
②该制备过程总反应的化学方程式为______。
数目为0.1NA


),下列说法正确的是

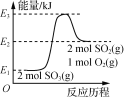 由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1
由图可知,2SO3(g)===2SO2(g)+O2(g) ΔH=(E1-E2)kJ·mol-1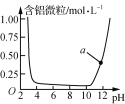 表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+
表示Al3+与OH-反应时溶液中含铝微粒浓度变化曲线,a点溶液中存在大量Al3+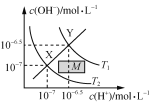 温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)
温度在T1和T2时水溶液中c(H+)和c(OH-)的关系,则阴影部分M内任意一点均满足c(H+)>c(OH-)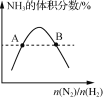 表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
表示反应N2(g)+3H2(g)=2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)溶液分别滴定
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
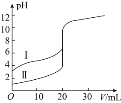
时,滴定醋酸消耗的
小于
时,两份溶液中
时,醋酸溶液中