-
下列叙述正确的是( )
A. 1molOH-的质量为17g
B. 二氧化碳的摩尔质量为44g
C. 铁原子的摩尔质量等于它的相对原子质量
D. 标准状况下,1mol 任何物质的体积均为22.4L
难度: 简单查看答案及解析
-
意大利罗马大学的FulvioCacsce 等人获得了极具理论研究意义的N4 分子,下列说法正确的是( )
A. N4属于一种新型的化合物
B. N4与N2的摩尔质量相等
C. 标准状况下,等体积的N4与N2所含的原子个数比为1:2
D. 等质量的N4与N2所含的原子个数比为1:1
难度: 中等查看答案及解析
-
下列分散系能产生“丁达尔效应”的是( )
A.葡萄糖溶液 B.淀粉溶液 C.盐酸 D.油水
难度: 简单查看答案及解析
-
ClO2是一种高效安全灭菌消毒剂。ClO2属于( )
A.酸 B.碱 C.盐 D.氧化物
难度: 中等查看答案及解析
-
下列物质属于电解质的是( )
A.稀硫酸 B.酒精 C.熔融的氯化钠 D.二氧化碳
难度: 中等查看答案及解析
-
下列仪器名称为“分液漏斗”的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
500 mL 2 mol·L-1的MgCl2溶液中含有氯离子的物质的量是( )
A.1 mol B.2 mol
C.3 mol D.1000 mol
难度: 简单查看答案及解析
-
生活、生产离不开化学。下列物质的分离方法中,利用粒子大小差异的是( )
A.海水晒盐 B.过滤豆浆 C.精油萃取 D.酿酒蒸馏
难度: 中等查看答案及解析
-
下列实验操作正确的是( )
A.用100 mL量筒量取5.5 mL稀盐酸
B.用托盘天平称量11.50g NaCl固体
C.使用容量瓶配制溶液,移液时应洗涤烧杯2~3次
D.配制一定浓度的溶液时,固体物质可以直接在容量瓶中溶解
难度: 中等查看答案及解析
-
已知A的原子序数是x,B-与A3+具有相同的电子层结构,则B元素的原子序数为( )
A.x+4 B.x-4 C.x+1 D.x-1
难度: 中等查看答案及解析
-
下列操作过程中一定有氧化还原反应发生的是( )
A.
 B.
B. 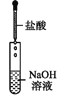 C.
C. 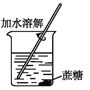 D.
D. 
难度: 简单查看答案及解析
-
化学兴趣小组进行化学实验,按照图(左)连接好线路发现灯泡不亮,按照图(右)连接好线路发现灯泡亮。由此得出的结论正确的是( )
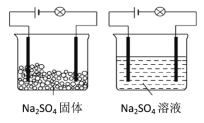
A.Na2SO4固体不导电,所以Na2SO4固体是非电解质
B.Na2SO4溶液能导电,所以Na2SO4溶液是电解质
C.Na2SO4在水溶液中电离方程式:Na2SO4=2Na++SO42-
D.Na2SO4溶液中,水电离出大量的离子
难度: 中等查看答案及解析
-
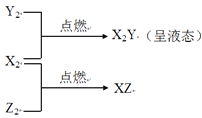
钇(Y)是稀土元素之一。下列关于
的说法中不正确的是( )
A.质量数是89
B.中子数与电子数之差为50
C.核外电子数是39
D.
和
互为同位素
难度: 中等查看答案及解析
-
实验室提纯含少量氯化钠杂质的硝酸钾的过程如右图所示。下列分析正确的是
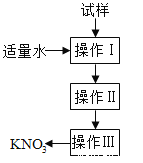
A.操作Ⅰ是过滤,将固体分离除去 B.操作Ⅱ是加热浓缩、趁热过滤,除去杂质氯化钠
C.操作Ⅲ是过滤、洗涤,将硝酸钾晶体从溶液中分离出来 D.操作Ⅰ~Ⅲ总共需两次过滤
难度: 中等查看答案及解析
-
同温同压下,同体积的甲、乙两种气体的质量比是17:14。若甲气体是H2S,则乙气体不可能是( )
A.N2 B.HCl C.C2H4 D.CO
难度: 中等查看答案及解析
-
下列反应中,氯元素全部被氧化的是
A.2Na+Cl2=2NaCl
B.2NaCl
2Na+Cl2↑
C.NaOH+HCl=NaCl+H2O
D.2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
难度: 中等查看答案及解析
-
实验室一试剂瓶的标签上标有“CaCl2 0.1mol·L-1”的字样,下列说法正确的是( )
A.Ca2+ 和Cl-的物质的量浓度都是1mol·L-1
B.配制1L该溶液,可将0.1mol的CaCl2溶于1L水
C.取该溶液的一半,则所取溶液c(CaCl2)=0.05mol·L-1
D.取少量该溶液加水至溶液体积为原来的二倍,所得溶液c(Cl−)=0.1mol·L-1
难度: 中等查看答案及解析
-
用玻璃棒蘸取新制氯水滴在pH试纸中部,观察到的现象是( )
A.
B.
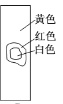 C.
C. 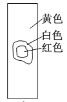 D.
D. 难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数。下列说法正确的是( )
A.阿伏伽德罗常数是6.02×1023
B.常温下,NA个Cl2分子所占有的体积为22.4L
C.32gO2和O3混合气体中含有原子数为2NA
D.1molHCl气体中的粒子数与0.5mol·L-1盐酸中溶质粒子数相等
难度: 困难查看答案及解析
-
下列图示中逻辑关系正确的是( )
A.

B.
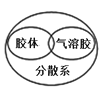
C.
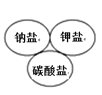
D.
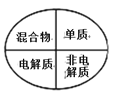
难度: 中等查看答案及解析
-
下列变化必须加入氧化剂才能实现的是
A. CuO→CuSO4 B. CO2→CO C. Fe→Fe3O4 D. KClO3→O2
难度: 中等查看答案及解析
-
符合如下实验过程和现象的试剂组是( )
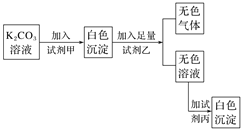
选项
甲
乙
丙
A
MgCl2
HNO3
K2SO4
B
BaCl2
HNO3
K2SO4
C
NaNO3
H2SO4
Ba(NO3)2
D
BaCl2
HCl
CaCl2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某日的玉田县空气质量指数如图所示,下列说法中正确的是( )

A.O3属于非电解质
B.SO2和CO均属于酸性氧化物
C.机动车限行可减少雾霾的产生,雾霾不能产生丁达尔效应
D.反应2NO2+2NaOH=NaNO3+NaNO2+H2O中,NO2既是氧化剂又是还原剂
难度: 中等查看答案及解析
-
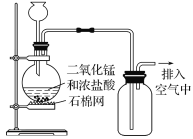
某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A.
 闻Cl2的气味
闻Cl2的气味B.
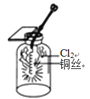 生成棕黄色的烟
生成棕黄色的烟C.
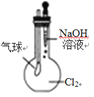 若气球干瘪,证明Cl2可与NaOH反应
若气球干瘪,证明Cl2可与NaOH反应D.
 浸有NaOH溶液的棉球用于吸收过量的氯气,以免其污染空气
浸有NaOH溶液的棉球用于吸收过量的氯气,以免其污染空气难度: 中等查看答案及解析