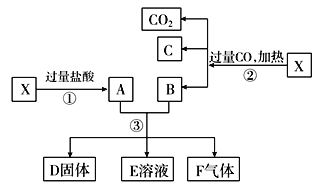
-
下列各组物质中,第一种是电解质,第二种是分散系,第三种是合金的是 ( )
A. 硫酸、CuSO4·5H2O、生铁 B. 酒精、空气、铜绿
C. 二氧化碳、明矾、熟石灰 D. 硝酸钾、食盐水、黄铜
难度: 简单查看答案及解析
-
用18.4mol•L﹣1的浓H2SO4配制100mL浓度为1mol•L﹣1的稀H2SO4的过程中,下列操作会引起浓度偏小的是( )
A. 容量瓶用蒸馏水洗涤后未烘干
B. 定容时俯视容量瓶的刻度线
C. 量取浓硫酸后,用少量蒸馏水洗涤量筒并将洗涤液也放入烧杯
D. 定容摇匀后发现液面低于刻度线,再加水至刻度线
难度: 简单查看答案及解析
-
我国明代《本草纲目》中收载药物1892种,其中“烧酒”条目下写道:“自元时始创其法,用浓酒和糟入甑,蒸令气上……其清如水,味极浓烈,盖酒露也。”这里所用的“法”是指 ( )
A.萃取 B.蒸馏 C.渗析 D.干馏
难度: 中等查看答案及解析
-
某合作学习小组讨论辨析以下说法。其中错误的是 ( )
A. 冰和干冰既是纯净物又是化合物
B. 纯碱和熟石灰都是碱
C. 盐酸和食醋都属于混合物
D. 豆浆和雾都是胶体
难度: 简单查看答案及解析
-
化学在日常生活中有着广泛的应用。下列说法不正确的是( )
A.硅是制造太阳能电池的常用材料
B.明矾可用于水的杀菌消毒
C.氢氟酸能与SiO2反应,故可用氢氟酸在玻璃上蚀刻标记
D.燃料的脱硫和脱氮都是减少酸雨产生的措施
难度: 简单查看答案及解析
-
有硫酸镁溶液500mL,它的密度是1.20g·cm−3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A.溶质的质量分数是24% B.溶液的物质的量浓度是2.4mol·L−1
C.溶质和溶剂的物质的量之比约为1∶21.1 D.硫酸根离子的质量是230.4g
难度: 中等查看答案及解析
-
容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度、②浓度、③容量、④压强、⑤刻度线、⑥酸式或碱式这六项中的
A.②④⑥ B.③⑤⑥ C.①②④ D.①③⑤
难度: 简单查看答案及解析
-
用四氯化碳萃取碘的饱和水溶液中的碘,下列说法中不正确的是
A.实验使用的主要仪器是分液漏斗
B.碘在四氯化碳中的溶解度比在水中的溶解度大
C.碘的四氯化碳溶液呈紫红色
D.分液时,水从分液漏斗下口流出,碘的四氯化碳溶液从漏斗上口倒出
难度: 中等查看答案及解析
-
11.某位同学配制一定物质的量浓度的NaOH溶液时,造成所配溶液浓度偏高的原因是( )
A.所用NaOH已经潮解 B.向容量瓶中加水未到刻度线
C.有少量NaOH溶液残留在烧杯里 D.称2.4gNaOH时误用了“左码右物”方法
难度: 简单查看答案及解析
-
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为( )
A. 10mol B. 11mol C. 12mol D. 13mol
难度: 中等查看答案及解析
-
某气体在标准状况下的密度为1.25 g / L,该气体的相对分子质量为( )
A.44 B.28 C.32 D.16
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列关于0.2 mol/L Ba(NO3)2溶液的叙述不正确的是
A. 2 L溶液中阴阳离子总数为1.2NA
B. 500 mL溶液中NO3-浓度为0.2 mol/L
C. 500 mL溶液中Ba2+浓度为0.2 mol/L
D. 500 mL溶液中NO3-物质的量为0.2 mol
难度: 中等查看答案及解析
-
为了检验某含有NaHCO3杂质的Na2CO3样品的纯度,现将w1g 样品加热,其质量变为w2g ,则该样品的纯度(质量分数)是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
在一定温度下,向饱和的烧碱溶液中加入一定量的过氧化钠,充分反应后恢复到原来温度,下列说法正确的是( )
A. 溶液中Na+浓度增大,有O2放出 B. 溶液碱性不变,有H2放出
C. 溶液中Na+数目减少,有O2放出 D. 溶液碱性增强,有O2放出
难度: 简单查看答案及解析
-
下列变化不能一步实现的是( )
A.Na2SiO3→H2SiO3 B.H2SiO3→SiO2
C.SiO2→H2SiO3 D.SiO2→Na2SiO3
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 久置在空气中的NaOH溶液,加盐酸时有气体产生
B. 50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应,生成0.15 mol Cl2
C. 在常温下,浓H2SO4不与Cu反应,是因为铜被钝化
D. CO2通入浓的CaCl2溶液中产生白色沉淀
难度: 中等查看答案及解析
-
向X的溶液中,加入Y试剂,产生的沉淀或气体的量如图所示,其中与所述情形相符的是
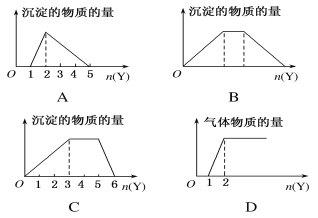
A. 向HCl和AlCl3的混合液中滴加NaOH溶液
B. 向NaOH和Ca(OH)2的混合液中通入CO2
C. 向NH4Al(SO4)2溶液中滴加NaOH溶液
D. 向NaOH和Na2CO3的混合液中滴加稀盐酸
难度: 中等查看答案及解析