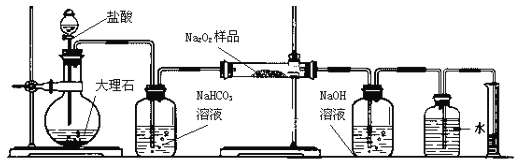
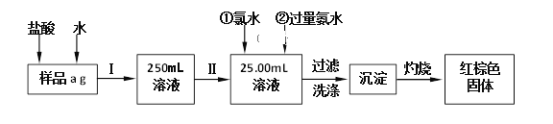
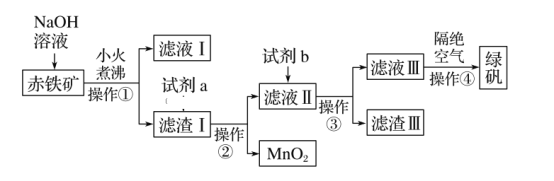
-
关于NaHCO3和Na2CO3的性质判断正确的是
A. 常温下溶解度:NaHCO3>Na2CO3
B. 常温下,相同物质的量浓度溶液的碱性:NaHCO3>Na2CO3
C. 热稳定性:NaHCO3<Na2CO3
D. 与同浓度、同体积的盐酸反应生成气体的快慢:NaHCO3<Na2CO3
难度: 简单查看答案及解析
-
下列物质中不属于铁合金的是
A. 不锈钢 B. 生铁 C. 碳素钢 D. 氧化铁
难度: 简单查看答案及解析
-
分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱 B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐 D.Fe2O3和Al2O3都属于碱性氧化物
难度: 中等查看答案及解析
-
下列有关物质性质与用途不具有对应关系的是
A.FeCl3溶液呈酸性,可用于腐蚀Cu
B.小苏打受热分解生成气体,可用作发酵粉
C.氢氧化铝具有两性,可用于中和过多胃酸
D.Al2O3熔点高,可用作耐高温材料
难度: 中等查看答案及解析
-
下列实验操作中不正确的是
A.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
B.蒸馏时,应将温度计水银球放在被加热的混合液中
C.过滤时,需要用玻璃棒引流
D.使用分液漏斗分液前要先检漏
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.金属钠和水反应:Na+2H2O = Na++2OH—+H2↑
B.Na2CO3溶液中加入稀盐酸:CO32- + 2H+ = CO2↑+ H2O
C.铁片放入稀硫酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑
D.将打磨后的铝丝插入NaOH溶液中:Al+2OH﹣=AlO2﹣+H2↑
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.23g Na与足量H2O反应完全后可生成NA个H2分子
B.标准状况下,11.2L H2O中含有的氧原子数为0.5NA
C.5.6g铁与足量盐酸反应转移的电子数为0.3NA
D.16g O2含有的氧原子数目为NA
难度: 中等查看答案及解析
-
下列关于金属的说法正确的是
A.钠与氧气反应时,产物是由氧气的用量决定的
B.铝箔在空气中受热可以熔化滴落
C.铜可以在加热的条件下和氧气反应,生成氧化铜
D.铁与水蒸气反应的产物是黑色的Fe2O3
难度: 困难查看答案及解析
-
下列实验方案中,不能达到实验目的的是
选项
实验目的
实验方案
A
制取Fe(OH)3胶体
向沸腾的蒸馏水中逐滴加入5~6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色,停止加热。
B
证明Al(OH)3是具有两性
向两份Al(OH)3沉淀中,分别加入足量盐酸和NaOH溶液,都能完全溶解。
C
证明溶液中含有Fe3+
向溶液中加入KSCN溶液,观察到溶液变变红
D
检验NaHCO3与Na2CO3溶液
用小试管分别取少量溶液,然后滴加澄清石灰水
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
为了验证Fe3+的性质,某化学兴趣小组设计了下图所示的一组实验,其中实验方案设计错误的是 ( )
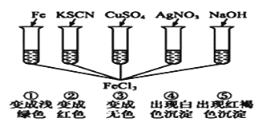
A. ② B. ③⑤ C. ③④ D. ①②③④⑤
难度: 简单查看答案及解析
-
下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是
①NaHCO3 ②Al2O3 ③Al ④Na2CO3 ⑤NaHSO4
A.②③④ B.①②③ C.①③④ D.全部
难度: 中等查看答案及解析
-
欲进行下列实验,其方案设计合理的是
A
B
C
D
检验装置气密性
实验室制备Fe(OH)2
制过氧化钠
NaHCO3和Na2CO3 的溶解度
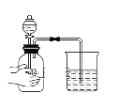
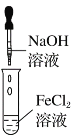
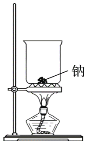
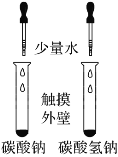
A.A B.B C.C D.D
难度: 中等查看答案及解析