-
化学与人类的生活、生产密切相关,下列说法中正确的是
A. 蚕丝和棉花的组成元素相同,结构不同,因而性质不同
B. “青蒿一握,以水二升渍,绞取之”,上述提取青蒿素的过程中发生了化学变化
C. 绿色化学的核心是应用化学原理对环境污染进行治理
D. 用浸泡过酸性KMnO4溶液的硅藻土吸收水果释放的乙烯,可达到水果保鲜的目的
难度: 中等查看答案及解析
-
下列有关实验操作描述正确的是
A.在沸水中分别滴加浓氢氧化钠、氯化铁溶液,可制备氢氧化铁胶体
B.用容量瓶配溶液时,若加水超过刻度线,立即用胶头滴管吸出多余液体
C.常见试纸:石蕊试纸、pH试纸、KI淀粉试纸在使用前均需润湿
D.酸式滴定管装标准液前,必须先用该溶液润洗
难度: 中等查看答案及解析
-
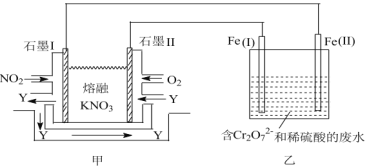
钠熔融盐燃料电池拥有比锂电池高一倍的能量密度,在同等电池体积下,可让电动汽车行驶距离成倍提升。如图所示是某钠熔融盐燃料电池,其中生成物Y是一种氧化物。下列说法不正确的是

A.电池工作时,石墨电极Ⅰ上电极反应式为2NO2-2e−+O2−=N2O5
B.电池工作时,
向石墨电极Ⅰ移动
C.该电池充电时,石墨电极Ⅱ连接电源的负极
D.电池工作时,外电路中流过1 mol电子,则消耗46 g NO2
难度: 中等查看答案及解析
-
已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L−1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
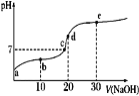
A.a点溶液的c(H+)=4×10-4mol·L-1
B.水电离程度:e>d>c>b>a
C.b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D.d点:c(OH-)=c(CH3COOH)+c(H+)
难度: 中等查看答案及解析
-
短周期元素R、T、Q、W、G在元素周期表中的相对位置如下表所示,其中Q是无机非金属材料的主角。下列判断正确的是( )
A.离子半径:T<W<G
B.等物质的量的W、G单质分别与足量铁粉反应,后者消耗的铁粉多
C.最简单气态氢化物的热稳定性:Q<R
D.T和G组成的化合物溶于水,其水溶液呈中性
难度: 中等查看答案及解析
-
下列说法正确的是
①合成纤维和光导纤维都是新型无机非金属材料
②硅酸可制备硅胶,硅胶可用作袋装食品、瓶装药品的干燥剂
③Mg2+、H+、SiO32-、SO42-在水溶液中能大量共存
④向含K+、Na+、Br-、SiO32-的溶液中通入CO2后仍能大量共存
⑤SiO2不与任何酸反应,可用石英制造耐酸容器
⑥硅酸钠可制备木材防火剂,也可用于制备硅酸胶体
⑦Si→SiO2→H2SiO3均能一步转化
A. ①⑤⑥ B. ①②⑥⑦ C. ②⑥ D. ③④⑥
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.MnO2与足量浓盐酸反应,当生成4.48LCl2时,转移电子数目为0.4NA
B.7.8gNa2S和Na2O2的混合物中含离子数目为0.3NA
C.铜的电解精炼过程中,当阳极消耗1molCu时,外电路通过电子数目为2NA
D.将1mL0.1mol/LFeCl3溶液加入沸水中,形成的Fe(OH)3胶体粒子数目为10-4NA
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是( )
A.碘化亚铁中通入过量氯气:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
B.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
C.1mol•L﹣1的NaAlO2溶液和2.5mol•L﹣1的HCl溶液等体积互相均匀混合:2AlO2﹣+5H+=Al3++Al(OH)3↓+H2O
D.用铜作电极电解CuSO4溶液:2Cu2++2H2O
2Cu+O2↑+4H+
难度: 中等查看答案及解析
-
在C(s)+CO2(g)
2CO(g)反应中,可使反应速率增大的措施是( )
①升高温度 ②增加碳的量 ③恒容通入CO2 ④恒压下充入N2 ⑤恒容下充入N2 ⑥恒容通入CO
A.①③④ B.②④⑥ C.①③⑥ D.③⑤⑥
难度: 简单查看答案及解析
-
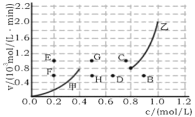
常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是
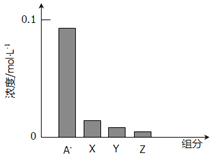
A.HA是强酸
B.该混合液pH=7
C.图中x表示HA,Y表示OH-,Z表示H+
D.该混合溶液中:c(A-)+c(Y)=c(Na+)
难度: 中等查看答案及解析
-
向HCl、AlCl3混合溶液中逐滴加入NaOH溶液,生成沉淀的量随NaOH溶液加入量的变化关系如图所示,则下列离子组在对应的溶液中一定能大量共存的是

A. M点对应的溶液中:K+、Fe2+、SO42-、NO3-
B. N点对应的溶液中:K+、NH4+、Cl-、CO32-
C. S点对应的溶液中:Na+、SO42-、HCO3-、NO3-
D. R点对应的溶液中:Na+、SO42-、Cl-、NO3-
难度: 困难查看答案及解析
-
某化学研究性学习小组对电解质溶液作如下的归纳总结(均在常温下),已知电离平衡常数:CH3COOH>H2CO3>C6H5OH>HCO3-,其中不正确的是( )
A.pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3 d.NaOH,则四种溶液的溶质的物质的量浓度由小到大顺序为:d<b<c<a
B.pH=4浓度均为0.1mol·L-1的CH3COOH、CH3COONa混合溶液中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
C.pH=2的一元酸和pH=12的二元强碱等体积混合:c(OH-)≤c(H+)
D.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
难度: 中等查看答案及解析
-
下列物质的转化在给定条件下能实现的是( )
A.H2SO4(稀)
SO2
NH4HSO3
(NH4)2SO3
B.NH3
NO
NO2
HNO3
C.Fe
FeCl2
Fe(OH)2
Fe(OH)3
D.Al
NaAlO2
AlCl3溶液
无水AlCl3
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
B.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的ΔH<0
C.CH3COOH溶液加水稀释后,溶液中
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
难度: 中等查看答案及解析
-
能表示H2(g)+ I2(g)
2HI(g)已经达到平衡状态的标志有几个( )
①c(H2)=c(I2)=c(HI)时②c(H2):c(I2):c(HI)=1:1:2时③c(H2)、c(I2)、c(HI)不再随时间而改变④单位时间内生成nmolH2的同时生成2nmolHI⑤单位时间内生成n mol H2的同时生成n mol I2 ⑥反应速v(H2)=v(I2)=1/2v(HI) ⑦一个H-H键断裂的同时有两个H-I键断裂⑧温度和体积一定时,容器内压强不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再变化⑪条件一定,混合气体的平均相对分子质量不再变化
A. 3 B. 4 C. 5 D. 6
难度: 简单查看答案及解析
-
根据下列实验操作和实验现象所得到的实验结论正确的是( )
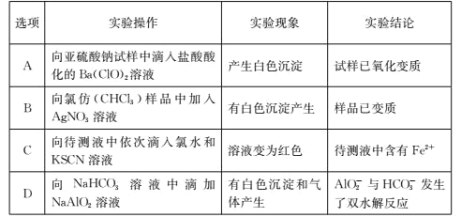
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2=NH4BO2+4H2O。已知两极室中电解质足量,下列说法正确的是( )
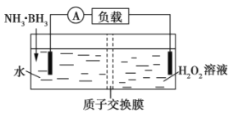
A.正极的电极反应式为2H++2e-═H2↑
B.电池工作时,H+通过质子交换膜向负极移动
C.电池工作时,正、负极分别放出H2和NH3
D.工作一段时间后,若左右两极室质量差为1.9g,则电路中转移0.6mol电子
难度: 中等查看答案及解析
-
有关
反应的叙述正确的为
A.还原剂与氧化剂物质的量之比为5:3
B.生成lmolO2,反应共转移4mol电子
C.若有5mol水做还原剂时,被BrF3还原的BrF3为
mol
D.若有5mol水参与反应时,被水还原的BrF3为2mol
难度: 困难查看答案及解析
-
改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知
]。下列叙述不正确的是( )
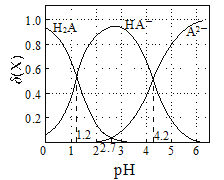
A.NaHA溶液中,HA-的水解能力小于HA-的电离能力
B.lg[K2(H2A)]=-4.2
C.将等物质的量的NaHA和Na2A混合物溶于水,所得的溶液中α(HA-)=α(A2-)
D.0.1 mol·L−1 NaHA溶液中:c(Na+)+c(A2−)+c(H2A)+c(HA−)=0.2 mol·L−1
难度: 困难查看答案及解析