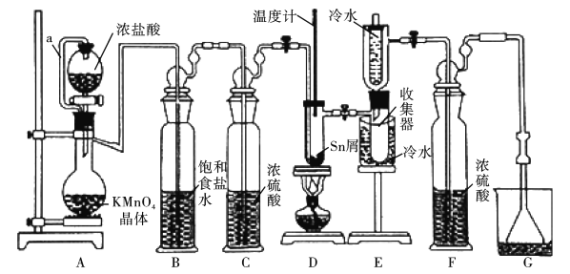
-
《经典咏流传》是档用流行音乐演绎经典诗词和文学作品、传承和传播中华优秀传统文化的电视节目。下列有关古诗词中蕴含化学知识的说法,错误的是
A.《客中行》:兰陵美酒郁金香,玉碗盛来琥珀光。但使主人能醉客,不知何处是他乡。”粮食发酵产生的酒精分散在酒糟中,可以通过蒸馏与洒糟分离
B.《蚕妇》:“昨日入城市,归来泪满巾。遍身罗绮者,不是养蚕人。”丝绸的主要成分是纤维素
C.《延州诗》:“二郎山下雪纷纷,旋卓穹庐学塞人。化尽素衣冬未老,石烟多似洛阳尘。”石油燃烧产生的黑烟可以用来制墨
D.《陶者》陶尽门前土,屋上无片瓦。十指不沾泥,鳞鳞居大厦。”黏土烧制陶器的过程中发生了化学变化
难度: 简单查看答案及解析
-
我国科学家研制了一种纳米反应器,用于催化草酸二甲酯(DMO)和氢气反应获得EG。反应过程示意图如下:
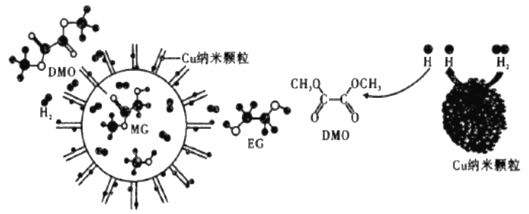
下列关于上述反应的说法不正确的是
A. Cu纳米颗粒将氢气解离成氢原子
B. MG是中间产物
C. DMO分子断裂的化学键有:C-O和C一H
D. 该反应生成物中有一种与乙醇是同系物
难度: 中等查看答案及解析
-
下列说法不正确的是 ( )
A.异丙苯(
)中所有碳原子不全在同一平面上
B.乙烯与乙醇都能使酸性KMnO4溶液褪色
C.
与
互为同分异构体,且二氯代物均为6种
D.苯的硝化和乙酸的酯化反应都是取代反应
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法不正确的是( )
A.将1 mol NH4Cl与少量的稀氨水混合后,溶液呈中性,则溶液中NH4+数目为NA
B.用浓盐酸分别与MnO2、KClO,反应制备1 mol氯气,转移的电子数均为2NA
C.工业上电解精炼银时,若阳极质量减少10.8 g,则电路中转移电子数不为0.1NA
D.1.0 g由H218O与D216O组成的混合物中所含中子数为0.5 NA
难度: 简单查看答案及解析
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,且Y、Q形成一种共价化合物,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是( )
A.X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B.Y、Q形成的化合物是强电解质
C.W、X、Q三种元素都能形成多种氧化物
D.电解X、Q元素组成的化合物的饱和溶液常被用于实验室制备E单质
难度: 中等查看答案及解析
-
学习中经常应用类推法。下列表格左边正确,类推法应用于右边也正确的是( )
A
向FeCl2溶液中滴入氯水
2Fe2++Cl2=2Fe3++2Cl—
向FeCl2溶液中滴入碘水
2Fe2++I2=2Fe3++2I—
B
向澄清石灰水中通入少量CO2气体
Ca2++2OH—+CO2 =CaCO3↓+H2O
向澄清石灰水中通入少量SO2 气体
Ca2++2OH—+SO2=CaSO3↓+H2O
C
向Na2CO3溶液中滴入稀HNO3
+2H+=CO2↑+H2O
向Na2SO3溶液中滴入稀HNO3
+2H+=SO2↑+H2O
D
锌粒放入硫酸亚铁溶液中
Zn+Fe2+=Zn2++Fe
钠投入硫酸铜溶液中
2Na+Cu2+=2Na++Cu
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.二氧化硫通入氯化铁溶液:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+
B.(NH4)2Fe(SO4)2溶液与过量NaOH 溶液反应:Fe2++2OH-=Fe(OH)2↓
C.向NaAlO2溶液中通入少量CO2:CO2+AlO2-+2H2O=Al(OH)3↓+HCO3-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
下列关于甲、乙、丙、丁四个图像的说法中,不正确的是( )


A.甲图表示1 L 1 mol·L-1 Na2SO3溶液吸收SO2溶液pH随n(SO2)的变化,则NaHSO3溶液显酸性
B.由图乙可知,a点Kw的数值与b点Kw的数值相等
C.图丙表示可得碱的强弱:ROH>MOH
D.图丁表示某温度BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点,最终变到c点
难度: 中等查看答案及解析
-
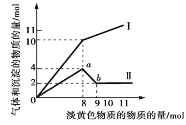
电解质溶液电导率越大导电能力越强。常温下用0.100 mol·L-1盐酸分别滴定10.00 mL浓度均为0.100 mol·L-1的NaOH溶液和二甲胺[(CH3)2NH]溶液(二甲胺在水中电离与氨相似,常温Kb[(CH3)2NH·H2O]=1.6×10-4]。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法不正确的是( )
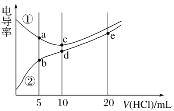
A.曲线②代表滴定二甲胺溶液的曲线
B.b点溶液中:pH<7
C.d点溶液中:c(H+)=c(OH-)+c[(CH3)2NH·H2O]
D.c、d、e三点的溶液中,水的电离程度最大的是d点
难度: 困难查看答案及解析
-
微生物燃料电池(MFC)是一种现代化氨氮去除技术。下图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法正确的是( )
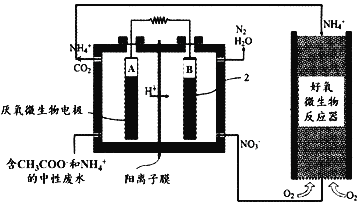
A.好氧微生物反应器中反应为:NH4++2O2=NO3-+2H++H2O
B.B极电势比A极电势低
C.A极的电极反应式CH3COO-+8e-+2H2O=2CO2+7H+
D.当电路中通过9mol电子时,理论上总共生成标况下33.6LN2
难度: 中等查看答案及解析
-
下列各组物质能满足如图所示转化关系的是(图中箭头表示一步转化)( )

a
b
c
d
①
Si
SiO2
H2SiO3
Na2SiO3
②
Al
AlCl3
NaAlO2
Al(OH)3
③
Cu
CuO
Cu(OH)2
CuSO4
④
Fe2O3
FeCl3
FeCl2
Fe
A.①② B.②③ C.③④ D.②④
难度: 中等查看答案及解析
-
在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生:CO(g)+2H2(g)
CH3OH(g) ΔH。测得CO的转化率随温度的变化及不同压强下CO转化率的变化、p2和195 ℃时n(H2)随时间的变化结果如图表所示。下列说法正确的是( )

A.0~3 min,平均速率v(CH3OH)=0.8 mol·L-1·min-1
B.p1<p2,ΔH>0
C.在p2和195 ℃时,该反应的平衡常数为25( mol·L-1)-2
D.在B点时,v正>v逆
难度: 中等查看答案及解析
-
以太阳能为热源,热化学硫碘循环分解水是一种高效、环保的制氢方法,其流程图如下:
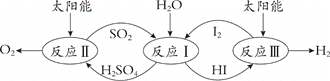
相关反应的热化学方程式为:
反应I:SO2(g) + I2(g) + 2H2O(l)=2HI(aq) + H2SO4(aq);ΔH1 =﹣213 kJ·mol-1
反应II:H2SO4(aq) =SO2(g) + H2O(l) +1/2O2(g);ΔH2 = +327 kJ·mol-1
反应III:2HI(aq) =H2(g) + I2(g); ΔH3 = +172 kJ·mol-1
下列说法不正确的是( )
A.该过程实现了太阳能到化学能的转化
B.SO2和I2对总反应起到了催化剂的作用
C.总反应的热化学方程式为:2H2O(l)=2H2 (g)+O2(g);ΔH = +286 kJ·mol-1
D.该过程降低了水分解制氢反应的活化能,但总反应的ΔH不变
难度: 简单查看答案及解析
-
用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,下列说法不正确的是( )
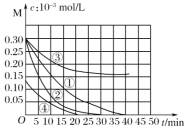
实验编号
温度℃
pH
①
25
1
②
45
1
③
25
7
④
25
1
A.实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B.若其他条件相同,实验①②说明升高温度,M降解速率增大
C.若其他条件相同,实验①③证明pH越高,越不利于M的降解
D.实验④说明M的浓度越小,降解的速率越快
难度: 中等查看答案及解析
-
25 ℃时,H3A水溶液(一种酸溶液)中含A的各种粒子的分布分数[平衡时某种粒子的浓度占各种粒子浓度之和的分数(α)]与pH的关系如图所示。下列叙述正确的是( )
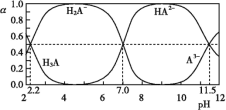
A.根据图,可得Ka1(H3A)≈10-7
B.将等物质的量的NaH2A和Na2HA混合物溶于水,所得的溶液中α(H2A-)=α(HA2-)
C.以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入H3A溶液中,当溶液由无色变为浅红色时停止滴加,则生成NaH2A
D.在上述含A的各种粒子的体系中,若溶液pH为11.5时,则c(H2A-)+5c(A3-)+c(OH-)=c(H+)
难度: 中等查看答案及解析
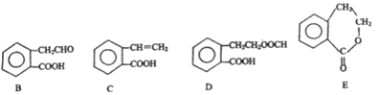
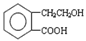 ,它可通过不间化学反应分別制得B、C、D和E四种物质。
,它可通过不间化学反应分別制得B、C、D和E四种物质。