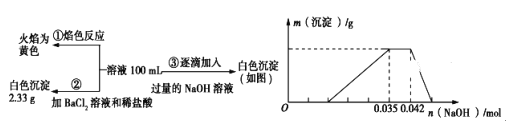
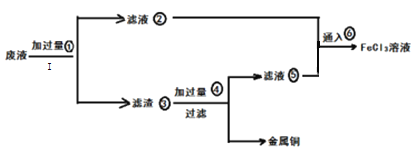
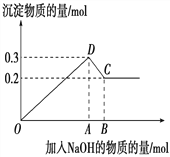
-
某溶液中有Mg2+、Fe2+、Al3+、Cu2+4种离子,若向其中加入过量的Na2O2固体,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是
A. Cu2+ B. Mg2+ C. Fe2+ D. Al3+
难度: 中等查看答案及解析
-
下列物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是
①NaHCO3 ②(NH4)2SO3 ③Al2O3 ④Al(OH)3 ⑤Al ⑥NaAlO2 ⑦SiO2
A. ①②③④⑤ B. ①③④⑤ C. ①③④⑤⑥ D. 全部
难度: 困难查看答案及解析
-
已知溶液中可以发生反应:①2FeCl3+2KI=2FeCl2+I2+2KCl ②Cl2+2FeCl2=2FeCl3,下列说法不正确的是
A. 反应①属于氧化还原反应,其中FeCl3做氧化剂
B. 由上述方程式可知氧化性顺序:Cl2>Fe3+>I2
C. I-也可以被Cl2氧化
D. 往2mL 0.1mol/L FeI2溶液中先滴入几滴氯水,再滴加几滴KSCN溶液,溶液变红
难度: 简单查看答案及解析
-
甲、乙、丙、丁分别是Al2(SO4)3、FeSO4、NaOH、BaCl2四种物质中的一种,若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴加则沉淀消失,丁溶液滴入甲溶液时,无明显现象发生,据此可判断丙物质是( )
A.Al2(SO4)3 B.NaOH C.BaCl2 D.FeSO4
难度: 中等查看答案及解析
-
下列说法不正确的是
A.用火箭燃料发射“天宫二号”的过程中,发生了氧化还原反应
B.“何意百炼钢,化为绕指柔”,其中钢指的是铁的合金
C.“声如罄、薄如纸”,瓷器的原料高岭土[Al2Si2O5(OH)4],可表示为:Al2O3·2SiO2·2H2O
D.“青蒿一握,以水二升渍,绞取汁”,诗句中体现的屠呦呦对青蒿素的提取属化学变化
难度: 简单查看答案及解析
-
下列变化中,需要加入氧化剂才能实现的是
A.KMnO4→MnCl2 B.Fe→FeCl2 C.CaCO3→CO2 D.CuO→Cu
难度: 简单查看答案及解析
-
下列实验方法正确的是
A. 用氨水鉴别MgCl2溶液和AlCl3溶液
B. 用丁达尔效应鉴别浓溴水和Fe(OH)3胶体
C. 利用右图所示方法检验溶液中是否含有K+
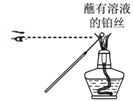
D. 用Cl2除去Fe2(SO4)3溶液中含有的FeSO4杂质
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.标准状况下,11.2L CCl4中含有的分子数目为0.5 NA
B.1 mol Fe参与反应失去电子数目一定为2NA
C.1 molNa被完全氧化生成Na2O2,失去2NA个电子
D.常温下,46 g NO2和N2O4的混合物中含有的氮原子数为NA
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.二氧化硅溶于氢氟酸溶液中: SiO2+4H++4F-=SiF4↑ +2H2O
B.偏铝酸钠溶液中通入过量的CO2:2AlO2- + CO2+3H2O=2Al(OH)3↓+ CO32-
C.稀硫酸加入氢氧化钡溶液中:H+ +
+ Ba2+ + OH-=BaSO4↓+ H2O
D.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
在下列溶液中,一定能大量共存的离子组是
A.在强酸性溶液中:Na+、K+、Cl-、HCO3-
B.加入金属铝有H2 产生的溶液中:Fe2+、Mg2+、NO3-、Cl-
C.含有大量 Fe3+的溶液中:SCN-、I-、K+、Br-
D.滴入酚酞变红的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列除杂质的方法不正确的是
A.铁粉中混有铝粉:加入过量NaOH溶液充分反应,过滤
B.FeCl2溶液中混有少量FeCl3:加入过量Cu粉 ,过滤
C.SiO2中混有Al2O3:加入过量盐酸充分反应,过滤
D.NaHCO3溶液中混有少量Na2CO3:往溶液中通入过量CO2气体
难度: 中等查看答案及解析
-
高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:
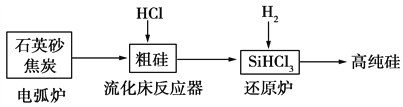
下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
难度: 中等查看答案及解析
-
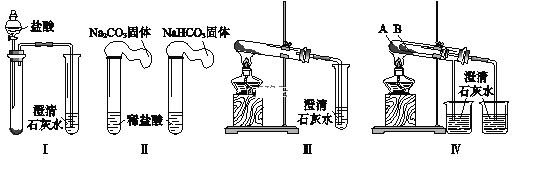
下列装置能达到实验目的的是
A.碳酸氢钠溶液直接蒸干得到碳酸氢钠固体
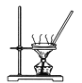
B.制备Fe(OH)2
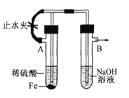
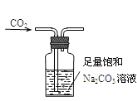
C.除去CO2中含有的少量HCl
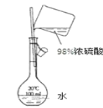
D.配制100mL 0.1mol/L的稀硫酸
难度: 中等查看答案及解析
-
将一定质量Fe2O3和Al2O3的混合固体溶解在200mL 0.1mol·L-1的过量H2SO4溶液中,然后向其中加入NaOH溶液使Fe3+、Al3+刚好完全沉淀,用去NaOH溶液100 mL,则NaOH溶液的浓度为
A.0.4 mol·L-1 B.0.2 mol·L-1
C.0.1 mol·L-1 D.0.8 mol·L-1
难度: 中等查看答案及解析
-
硫代硫酸钠可作为脱氯剂,已知25.0mL 0.100 mol·L-1 Na2S2O3溶液恰好把224mL(标准状况下)Cl2完全转化为Cl-离子,则S2O32-将转化成( )
A.S2- B.S C.SO32- D.SO42-
难度: 中等查看答案及解析