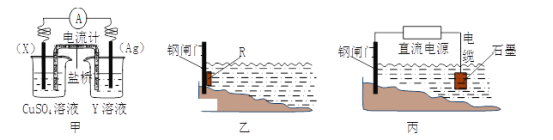
-
下图是反应CO(g)+2H2(g) = CH3OH(g)进行过程中的能量变化曲线。下列相关说法正确的是
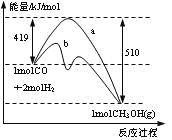
A.该反应是吸热反应
B.使用催化剂后反应热减小
C.热化学方程式为CO(g)+2H2(g) = CH3OH(g)△H=-510 kJ·mol-1
D.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化
难度: 简单查看答案及解析
-
一定温度下,在2 L固定容积的密闭容器中发生反应: 2N2O5(g)
4NO2(g) + O2(g)ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中正确的是
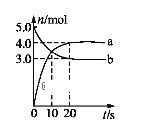
A.曲线a表示NO2的物质的量随反应时间的变化
B.0-20 s内平均反应速率v(N2O5) = 0.1 mol·(L·s)-1
C.10 s时,正、逆反应速率相等,达到平衡
D.20 s时,正反应速率大于逆反应速率
难度: 中等查看答案及解析
-
某华人科学家和他的团队研发出“纸电池” (如图)。这种一面镀锌、一面镀二氧化锰的超薄电池在使用印刷与压层技术后,变成一张可任意裁剪大小的“电纸”,厚度仅为0.5毫米,可以任意弯曲和裁剪。纸内的离子“流过”水和氧化锌组成电解液,电池总反应式为: Zn+2MnO2+H2O=ZnO+2MnO(OH)。下列说法正确的是

A.该电池的正极材料为锌
B.该电池反应中二氧化锰发生了氧化反应
C.电池的正极反应式为2MnO2 +2H2O+2e-= 2MnO(OH)+2OH-
D.当有0.1mol锌溶解时,流经电解液的电子数为1.204×1023
难度: 简单查看答案及解析
-
不同温度(T1和T2)时,硫酸钡在水中的沉淀溶解平衡曲线如图所示,已知硫酸钡在水中溶解时吸收热量。下列说法正确的是( )
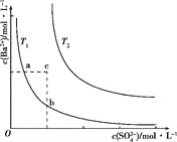
A.T1>T2
B.加入BaCl2固体,可使a点变成c点
C.c点时,在T1、T2两个温度下均有固体析出
D.a点和b点的Ksp相等
难度: 困难查看答案及解析
-
在一固定容积的密闭容器中,可逆反应: H2(g) + I2(g)
2HI (g)达到平衡的标志是
A.H2、I2、HI的分子数之比为1∶1∶2
B.混合气体的密度保持不变
C.单位时间生成n mol H2,同时消耗2n mol HI
D.混合气体的颜色不再发生变化
难度: 简单查看答案及解析
-
LiFePO4新型锂离子动力电池以其独特的优势成为奥运会绿色能源的新宠。已知该电池放电时的电极反应式为:正极:FePO4+Li++e-=LiFePO4,负极:Li-e-=Li+。下列说法中正确的是
A.充电时的总反应为FePO4+Li=LiFePO4
B.充电时动力电池上标注“+”的电极应与外接电源的正极相连
C.放电时电池内部Li+向负极移动
D.放电时,在正极上是Li+得电子被还原
难度: 中等查看答案及解析
-
如图是工业电解饱和食盐水的装置示意图,下列有关说法中不正确的是( )
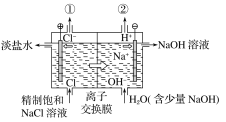
A.装置中出口①处的物质是氯气,出口②处的物质是氢气
B.该离子交换膜只能让阳离子通过,不能让阴离子通过
C.装置中发生反应的离子方程式为Cl-+2H+
Cl2↑+H2↑
D.该装置是将电能转化为化学能
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析