-
央视栏目《国家宝藏》不仅介绍了历史文化知识,彰显了民族自信、文化自信, 历史文物本身也蕴含着许多化学知识。下列说法错误的是 ( )
A.南朝·《竹林七贤与启荣期》砖画的砖块的主要成分是硅酸盐
B.战国·曾侯乙编钟属于青铜制品,青铜是一种铜锡合金
C.清·乾隆“瓷母”—各种釉彩大瓶中的红色窑变釉的主要成分可能是氧化铜
D.宋·王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
难度: 简单查看答案及解析
-
下列有关NA的叙述正确的是( )
A.将22.4LCl2通入水中,HClO、Cl-、ClO-的粒子数之和为2NA
B.1molAlCl3在熔融状态时含有的离子总数为4NA
C.1molNa2O2与足量CO2充分反应后转移电子数为2NA
D.一定条件下,28g的乙烯和环己烷混合气体中所含原子总数为6NA
难度: 中等查看答案及解析
-
根据如下能量关系示意图分析,下列说法正确的是( )
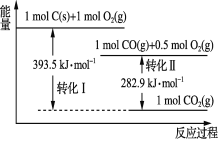
A.1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B.反应2CO(g)+O2(g)=2CO2(g)中,反应物的总键能小于生成物的总键能
C.C→CO的热化学方程式为2C(s)+O2(g)=2CO(g) ΔH=-110.6 kJ·mol-1
D.热值是指一定条件下单位质量的物质完全燃烧所放出的热量,则CO的热值为282.9 kJ·g-1
难度: 中等查看答案及解析
-
有一澄清透明溶液,只可能含有大量H+、Fe3+、Fe2+、Al3+、AlO2﹣、CO32﹣、NO3﹣七种离子中的几种,向溶液中逐滴加入一定量1mol/L的NaOH溶液的过程中,开始没有沉淀,而后有沉淀,沉淀达最大量后继续滴加NaOH溶液,沉淀部分溶解。下列判断正确的是 ( )
A.一定含有H+、NO3-、Fe3+、Al3+ B.一定含有Al3+,Fe3+、Fe2+至少含有一种或两种皆有
C.溶液可能含有NO3﹣ D.一定不含Fe3+和Fe2+
难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向浓度均为0.05 mol·L−1的NaI、NaCl混合溶液中滴加少量AgNO3溶液,有黄色沉淀生成
Ksp(AgI)> Ksp(AgCl)
C
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
Br2的氧化性比I2的强
D
用pH试纸测得:CH3COONa溶液的pH约为
9,NaNO2溶液的pH约为8
HNO2电离出H+的能力比CH3COOH的强
A.A B.B C.C D.D
难度: 困难查看答案及解析
-
短周期主族元素 W、X、Y、Z 的原子序数依次递增。X和Z形成的化合物的水溶液在常温下 pH=7,W 和X的最外层电子数之和等于Z的最外层电子数,Y的原子序数是W的2倍,下列说法正确的是( )
A.简单气态氢化物的稳定性:Y>Z B.Y 的单质易溶于水和乙醇
C.原子半径大小:W<X<Y<Z D.W 与 X 形成的化合物可能含有共价键
难度: 简单查看答案及解析
-
用下列实验装置进行相应实验,设计正确且能达到实验目的的是
A.
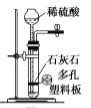 用于实验室制取少量CO2
用于实验室制取少量CO2B.
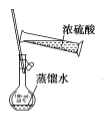 用于配制一定物质的量浓度的硫酸
用于配制一定物质的量浓度的硫酸C.
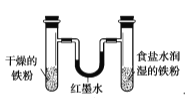 用于模拟生铁的电化学腐蚀
用于模拟生铁的电化学腐蚀D.
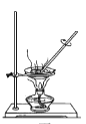 用于蒸干AlCl3溶液制备无水AlCl3
用于蒸干AlCl3溶液制备无水AlCl3难度: 中等查看答案及解析
-
常温下,下列叙述正确的是 ( )
A.pH=a的氨水,稀释10倍后,其pH=b,则a=b+1
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C.向10mL pH=11的氨水中,加入10mL pH=3的H2SO4溶液,混合液pH=7
D.向10 mL 0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,c(NH4+)/c(NH3.H2O ) 将减小
难度: 中等查看答案及解析
-
中科院科学家设计出-套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )
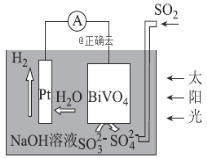
A.该电化学装置中,Pt电极作正极
B.BiVO4电极上的反应式为
C.电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D.OH-移向BiVO4电极
难度: 中等查看答案及解析
-
O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生反应如下:反应①O3
O2+[O]ΔH>0平衡常数为K1;反应②[O]+O3
2O2ΔH<0平衡常数为K2;总反应:2O3
3O2ΔH<0衡常数为K。下列叙述正确的是( )
A.升高温度,K增大 B.K=K1+K2
C.适当升温,可提高消毒效率 D.压强增大,K2减小
难度: 中等查看答案及解析
-
在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析正确的是

A.b→d反应的离子方程式为:H++OH-=H2O
B.o→a反应的离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C.c点导电能力相同,所以两溶液中含有相同量的OH–
D.a、b两点Ba2+均沉淀完全,所以对应的溶液均显中性
难度: 中等查看答案及解析
-
中学常见的某反应化学方程式为X +Y→M+N +H2O(未配平,反应条件已略去),下列叙述错误的是
A. 若X、Y的物质的量之比为1:4,且N是黄绿色气体,则该反应的离子方程式为MnO2+4H++2Cl-
Mn2++Cl2↑+2H2O
B. 若M、N为气体,且都能使澄清石灰水变浑浊,则将此混合气体通入溴水中,橙色褪色,橙色褪色过程的离子方程式为SO2+Br2+2H2O=4H++SO42-+2Br-
C. 若X是铁,Y是稀硝酸(过量),则X与Y反应的离子方程式为Fe+4H++NO3- = Fe3+ +NO↑+2H2O
D. 当N为氯碱工业的主要原料,M是造成温室效应的主要气体,则上述反应的离子方程式一定为:CO32-+2H+=CO2↑+H2O
难度: 困难查看答案及解析
-
海洋中有丰富的食品、矿产、能源、药物和水产资源,如图为海水利用的部分过程。
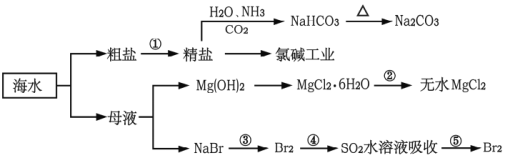
下列有关说法正确的是
A.制取NaHCO3的反应是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生使湿润淀粉碘化钾试纸变蓝的气体
C.可直接加热MgCl2·6H2O制备无水MgCl2
D.在步骤④中,SO2水溶液吸收Br2后,溶液的pH值增大
难度: 中等查看答案及解析
-
碱式氯化铜[CuaClb(OH)c•H2O]是一种重要的无机杀虫剂,它可以通过以下步骤制备。步骤1:将铜粉加入稀盐酸中,并持续通空气反应后生成CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示

步骤2:在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜。下列有关说法正确的是( )
A.a、b、c之间的关系式为:a=b+c
B.图中M、N分别为Fe2+、Fe3+
C.步骤1充分反应后,加入CuO是为了除去Fe3+
D.若制备1molCuCl2,理论上消耗11.2LO2
难度: 中等查看答案及解析
-
戊醇C5H11OH与下列物质发生反应时,所得产物可能结构种数最少(不考虑立体异构)的是( )
A.与浓氢溴酸卤代
B.与浓硫酸共热消去
C.铜催化氧化
D.与戊酸催化酯化
难度: 中等查看答案及解析
-
在如图所示的三个容积相同的容器①②③中进行如下反应:3A(g)+B(g)
2C(g) ΔH<0,若起始温度相同,分别向三个容器中通入3 mol A和1 mol B,则达到平衡时各容器中C物质的体积分数由大到小的顺序为( )

A. ③②① B. ③①② C. ①②③ D. ②①③
难度: 困难查看答案及解析
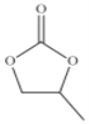
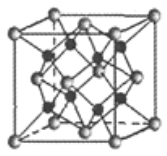
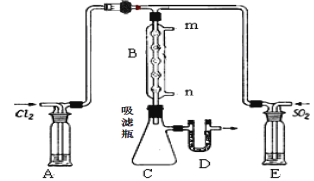
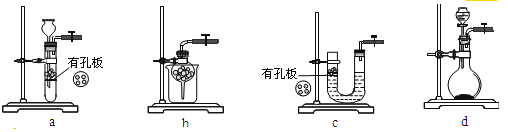
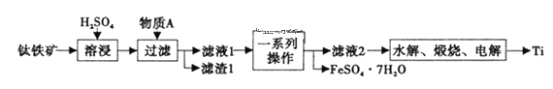
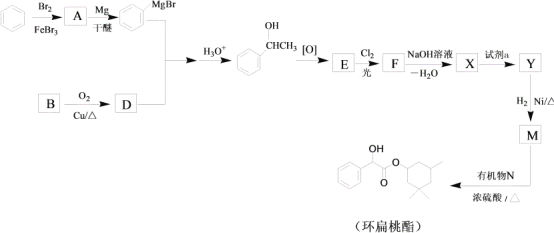
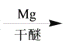 R-MgX
R-MgX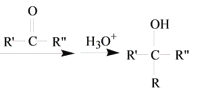 (R、R’、R”代表烃基或氢)
(R、R’、R”代表烃基或氢)