-
M2O72-与S2-在酸性溶液部反应:M2O72-+3S2-+14H+=2M3++3S↓+7H2O,则M2O72-中M的化合价是( )
A.+2 B.+3 C.+4 D.+6
难度: 中等查看答案及解析
-
下列关于纯净物、混合物、电解质、非电解质的正确组合为
纯净物
混合物
电解质
非电解质
A
盐酸
冰水混合物
硫酸
干冰
B
蒸馏水
蔗糖溶液
氧化铝
二氧化硫
C
胆矾
盐酸
铁
碳酸钙
D
胆矾
食盐水
氯化铜
碳酸钠
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列操作过程中一定有氧化还原反应发生的是( )
A.
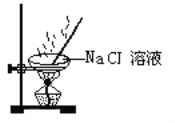 B.
B.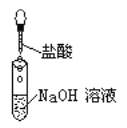
C.
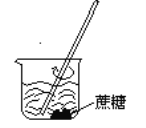 D.
D.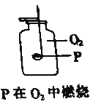
难度: 简单查看答案及解析
-
现有NaOH、Na2CO3和Ba(OH)2三种无色溶液,用一种试剂就可将它们鉴别出来,这种试剂是
A.HCl B.H2SO4 C.Na2SO4 D.CaCl2
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.FeCl3溶液腐蚀印刷电路铜板:Cu+Fe3+=Cu2++Fe2+
B.醋酸溶解鸡蛋壳:2H++CaCO3=Ca2++CO2↑+H2O
C.在NaHSO4溶液中滴入Ba(OH)2溶液至溶液呈中性:Ba2++2OH-+2H++SO
=BaSO4↓+2H2O
D.在NaHCO3溶液中滴入少量澄清石灰水:HCO
+Ca2++OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
MgCl2·nH2O常用于“点豆腐”,取2.03 g此结晶水合物溶于水,加入足量的AgNO3溶液,得到氯化银沉淀2.87 g。则n的值是( )
A.4 B.6 C.8 D.10
难度: 中等查看答案及解析
-
某溶液经分析,其中只含有Na+、K+、Ca2+、Cl-、NO3-,已知其中Na+、K+、Ca2+、NO的浓度均为0.1 mol·L-1,则Cl-的物质的量浓度为
A.0.1mol·L-1 B.0.3mol·L-1 C.0.2mol·L-1 D.0.4mol·L-1
难度: 中等查看答案及解析
-
现要配制0.01 mol/L的KMnO4溶液,下列操作导致所配溶液浓度偏高的是 ( )
A.称量时,左盘高,右盘低 B.定容时俯视容量瓶刻度线
C.原容量瓶洗净后没有干燥 D.摇匀后见液面下降,再加水至刻度线
难度: 简单查看答案及解析
-
关于O2与O3气体,下列比值一定为2:3的是
A.若两种气体所占体积相同,两种气体的质量之比
B.若温度及压强相同,两种气体的密度之比
C.若两种气体原子数相同,两种气体的质子数之比
D.若两种气体的质量相同,两种气体的分子数之比
难度: 简单查看答案及解析
-
下列分离物质的方法正确的是( )
A.用萃取的方法除去花生油中的水分
B.用过滤的方法除去NaCl溶液中含有的少量KNO3
C.用酒精萃取碘水中的碘
D.用蒸馏的方法除去水中的不挥发性杂质
难度: 简单查看答案及解析
-
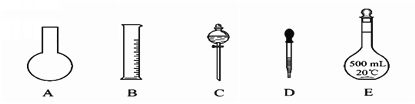
下列化学实验基本操作正确的是( )
A.点燃酒精灯
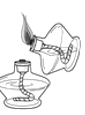 B.称量10.05 g固体
B.称量10.05 g固体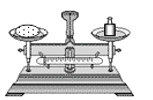
C.液体加热
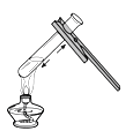 D.用100 mL量筒量取9.5 mL液体
D.用100 mL量筒量取9.5 mL液体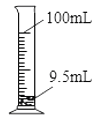
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.标准状况下,11.2 L水所含分子数为0.5 NA
B.体积相同的氢气和氧气所含的分子数相等
C.常温常压下,48 g O2与O3混合气体中所含原子数为3 NA
D.0.5 mol·L-1 Fe2(SO4)3溶液中,SO42−的数目为1.5 NA
难度: 中等查看答案及解析
-
在无色透明的酸性溶液中,能大量共存的离子组是( )
A.Al3+、NH4+、Cl‾、HCO3‾ B.Na+、NO3‾、SO42-、Fe2+
C.Na+、Mg2+、Cl‾、SO42- D.Fe3+、K+、Cl‾、NO3‾
难度: 简单查看答案及解析
-
已知反应①2A-+B2=2B-+A2;②2C-+A2=2A-+C2;③2B-+D2=2D-+B2;下列物质说法正确的是( )
A.氧化性:A2>B2>C2>D2 B.还原性:C->B->D->A-
C.2A-+D2=2D-+A2反应可以进行 D.2C-+B2=2B-+C2反应不可以进行
难度: 中等查看答案及解析
-
有硫酸镁溶液500mL,它的密度是1.20g·cm−3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A.溶质的质量分数是24% B.溶液的物质的量浓度是2.4mol·L−1
C.溶质和溶剂的物质的量之比约为1∶21.1 D.硫酸根离子的质量是230.4g
难度: 中等查看答案及解析
-
向盛有一定量的Ba(OH)2溶液中逐滴加入稀硫酸,直至过量,整个过程中混合溶液的导电能力(用电流强度I表示)近似的用下图中的曲线表示是( )

A. A B. B C. C D. D
难度: 中等查看答案及解析
 B.
B. C.
C.