-
下列水溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=1.0×10-7mol·L-1的溶液
C.c(H+)=c(OH-)的溶液 D.pH=3的酸与pH=11的碱等体积混合后的溶液
难度: 简单查看答案及解析
-
室温下,稀氨水中存在电离平衡
,有关叙述正确的是( )
A.加入氯化铵固体,溶液中
减小 B.加水不断稀释,溶液碱性一定增强
C.加水稀释,平衡常数
增大 D.加入NaOH固体,平衡逆向移动
难度: 简单查看答案及解析
-
下列溶液中有关物质的量浓度关系不正确的是
A.pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+) +c(M+) ==c(OH-) +c(A-)
B.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(Na2CO3)<c(CH3COONa)
C.物质的量浓度相等CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-) +2c(OH-) = 2c(H+) +c(CH3COOH)
D.0.1 mol/L的NaHA溶液,其pH = 4:c(HA-)>c(H+)>c(H2A)>c(A2—)
难度: 困难查看答案及解析
-
下列叙述中一定正确的是
A.任何浓度溶液的酸碱性都可用pH试纸测定
B.某温度下,pH=6.2的纯水显酸性
C.25℃时,pH=1的醋酸溶液中c(H+)是pH=2的盐酸溶液中c(H+)的10倍
D.25℃时,pH=12的NaOH溶液中的n(OH-)=10-2mol
难度: 中等查看答案及解析
-
某盐的混合物溶液中含有
、
、
、
种离子,其3种浓度分别为
、
、
,则
为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
25℃时,水的电离达到平衡:
,下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.向水中加入少量盐酸,c(H+)增大,Kw不变
C.向水中加入NaOH固体,平衡逆向移动,c(OH-)降低
D.向水中加入AlCl3固体,平衡正向移动,c(OH-)增大
难度: 中等查看答案及解析
-
下列叙述正确的是
A.某醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a>b
B.常温下,某溶液中由水电离的c(OH-) = 1.0×10-13mol/L,则此溶液一定呈酸性
C.25℃时,将pH=4的盐酸稀释1000倍后,溶液的pH=7
D.25℃时,pH=13的强碱溶液与pH=2的强酸溶液混合,若所得混合液的pH=7,则强碱与强酸的体积比是1:10
难度: 中等查看答案及解析
-
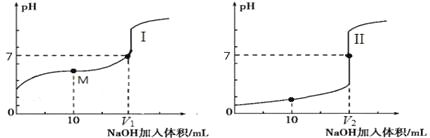
t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A.在t ℃时,AgBr的Ksp为4.9×10-13
B.通过蒸发,可使溶液由a点变到c点
C.图中b点有AgBr沉淀析出
D.在t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数K≈816
难度: 中等查看答案及解析
-
c(OH-)相同的氢氧化钠溶液和氨水,分别用蒸馏水稀释至原体积的m倍和n倍,若稀释后两溶液的c(OH-)仍相同,则m和n的关系是( )
A.m>n B.m=n C.m<n D.不能确定
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A.
的溶液中:
、
、
、
B.由水电离的c(H+)=1×10-14mol/L的溶液中:
、
、
、
C.
的溶液中:
、
、
、
D.
的溶液中:
、
、
、
难度: 中等查看答案及解析
-
有溶质的物质的量浓度均为
的下列八种溶液①HCl ②H2SO4 ③CH3COOH ④(NH4)2SO4 ⑤KOH ⑥NaF⑦ KCl ⑧NH4Cl 这些溶液的pH由小到大的顺序是( )
A.②①③④⑧⑦⑥⑤
B.②①③⑥⑦⑧⑤④
C.①②③⑧⑦⑥④⑤
D.②①⑧③⑥④⑤
难度: 中等查看答案及解析
-
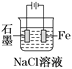
控制适合的条件,将反应
设计成如右图所示的原电池。下列判断不正确的是
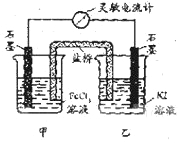
A.反应开始时,乙中石墨电极上发生氧化反应 B.反应开始时,甲中石墨电极上Fe3+被还原 C.电流计读数为零时,反应达到化学平衡状态 D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
难度: 中等查看答案及解析
-
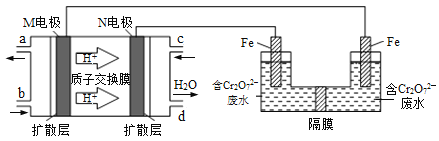
通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是
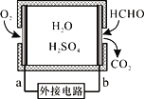
A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
难度: 中等查看答案及解析
-
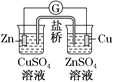
根据图,下列判断正确的是
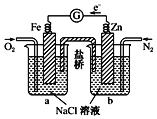
A. 电子从Zn极流出,流入Fe极,经盐桥回到Zn极
B. 烧杯b中发生的电极反应为
C. 烧杯a中发生反应
,溶液pH降低
D. 向烧杯a中加入少量KSCN溶液,则溶液会变成红色
难度: 中等查看答案及解析
-
电动汽车以锂电池提供动力,锂电池技术已经成为汽车研究的前沿科技某锂电池的电池反应为:xLi+Li3-xNiCoMnO6
Li3NiCoMnO6,下列说法正确的是
A.该电池的充、放电过程互为可逆反应
B.放电时,电池的负极反应为Li-e-=Li+
C.放电过程中,Li+向电池的负极移动
D.该电池可以采用醋酸、乙醇等作为电解质溶液
难度: 中等查看答案及解析
-
0.4mol CuSO4和0.4mol NaCl溶于水,配成1L溶液,用惰性电极进行电解,当—个电极得到0.3molCu时,另一个电极上生成的气体在标准状况下的体积是
A.5.6L B.6.72L
C.1.344L D.11.2L
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温电解H2OCO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
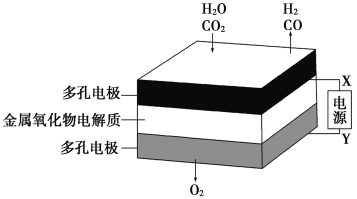
A.X是电源的负极
B.阴、阳两极生成的气体的物质的量之比是1∶1
C.总反应可表示为H2O+CO2
H2+CO+O2
D.阴极的电极反应式是H2O+2e-=H2+O2-、CO2+2e-=CO+O2-
难度: 中等查看答案及解析
-
下列有关电化学装置完全正确的是
A
B
C
D

铜的精炼
铁上镀银
防止Fe被腐蚀
构成铜锌原电池
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
利用三室式电解池(装置结构如图所示,电极均为惰性电极)可以实现用硫酸钠溶液制取硫酸和氢氧化钠。下列叙述正确的是
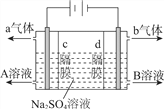
A.a气体为氢气,b气体为氧气
B.A为氢氧化钠溶液,B为硫酸溶液
C.通电后中问隔室的SO42-向阴极迁移,阳极区溶液的pH增大
D.该电解反应的方程式为2Na2SO4+6H2O
2H2SO4+4NaOH+O2↑+2H2↑
难度: 中等查看答案及解析
-
用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
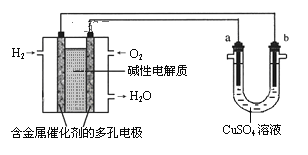
A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.
的纯水中,
B.向
溶液中加入少量NaOH固体,
、
均增大
C.室温下,
的
溶液与
的NaOH溶液等体积混合后溶液
D.
溶液中
难度: 中等查看答案及解析
-
某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。一段时间后,断开电键K,下列物质能使乙池恢复到反应前浓度的是
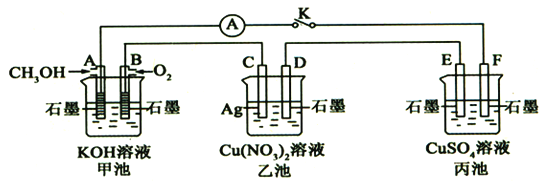
A.Cu B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
难度: 中等查看答案及解析