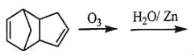
-
能证明乙炔分子中含有碳碳叁键的是 ( )
A. 乙炔能使溴水褪色
B. 乙炔能使酸性KMnO4溶液褪色
C. 乙炔可以和HCl气体加成
D. 1 mol乙炔可以和2 mol氢气发生加成反应
难度: 中等查看答案及解析
-
下列关于化学与生产、生活的认识不正确的是( )
A.石油分馏得到的汽油是纯净物
B.使用清洁能源是防止酸雨发生的重要措施之一
C.燃料电池是将化学能直接转化为电能的装置,所以能量利用率高
D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺
难度: 简单查看答案及解析
-
下列热化学方程式中,正确的是( )
A. 甲烷的燃烧热为 890.3 kJ/mol,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol
B. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭容器中充分反应生成 NH3(g),放热 19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
 2NH3(g) △H = -38.6 kJ/mol
2NH3(g) △H = -38.6 kJ/molC. 稀盐酸和 稀氢氧化钠溶液混合, 其热化学方程式为:H+(aq)+OH-(aq)=H2O(1) △H = -57.3 kJ/mol
D. 1molH2完全燃烧放热 142.9kJ,则氢气燃烧的热化学方程式为: 2H2(g)+O2(g)=2H2O(1)△H =+285.8 kJ/mol
难度: 中等查看答案及解析
-
25℃,四种水溶液① HCl ,② FeCl3 ,③ KOH ,④ Na2CO3 四种水溶液的pH依次为 4、4 、10 、10 ,各溶液中水的电离程度大小关系正确的是 ( )
A.①=②=③=④ B.①>③>②>④ C.④=②>③=① D.①=③>②=④
难度: 中等查看答案及解析
-
常温时,将CH3COOH溶液和NaOH溶液等体积混合后,溶液呈中性。则下列各项正确的是 ( )。
A.混合前:pH(CH3COOH)+pH(NaOH)=14
B.混合后:c(Na+)=c(CH3COO-)+c(OH-)
C.混合前:c(CH3COOH)>c(NaOH)
D.混合后:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
室温下,有下列四种溶液:①0.1mol·L-1氨水,②0.1mol·L -1 NH4Cl溶液,③0.2mol·L -1 盐酸与0.2mol·L -1 NH4Cl溶液等体积混合,④0.2mol·L -1 NaOH溶液与0.2mol·L -1 氨水等体积混合,四种溶液中c(NH4+ )由大到小排列正确的是( )
A.②③④① B.④①②③ C.①④②③ D.③②①④
难度: 中等查看答案及解析
-
下列过程一定不能自发进行的是( )
A.2N2O5(g)=4NO2(g)+O2(g) ΔH>0
B.2H2(g)+O2(g)=2H2O(l) ΔH<0
C.(NH4)2CO3(s)=NH4HCO3(s)+NH3(g) ΔH>0
D.2CO(g)=2C(s)+O2(g) ΔH>0
难度: 简单查看答案及解析
-
在t℃时AgBr在水中的沉淀溶解平衡曲线如图所示。t℃时AgCl的Ksp=4×10-10,下列说法不正确的是
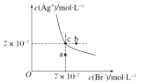
A.在t℃时,AgBr 的 Ksp为4.9×10-13
B.在 t ℃时,AgCl(s)+Br-(aq)
AgBr(s)+Cl-(aq)的平衡常数 K≈816
C.图中a点对应的是AgBr的不饱和溶液
D.在 AgBr 饱和溶液中加入NaBr固体,可使溶液由c点变到b点
难度: 中等查看答案及解析
-
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( )
A.正极反应式:Ag+Cl--e-=AgCl B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动 D.AgCl是还原产物
难度: 中等查看答案及解析
-
下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是( )
A.地下钢管连接锌板 B.水中的钢闸门连接电源的负极
C.铁件镀铜 D.金属护拦表面涂漆
难度: 简单查看答案及解析
-
在体积一定的密闭容器中,给定物质A、B、C的量,在一定条件下发生反应,建立如下化学平衡:aA(g)+ bB(g)
xC(g),符合图(1)所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图(2)中,Y轴是指
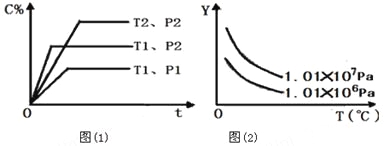
A.反应物A的百分含量 B.反应物B的平衡转化率
C.平衡混合气的密度 D.平衡混合气的总物质的量
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A. 新戊烷的结构简式:C5H12 B. 丙烷的比例模型:
C. 四氯化碳的电子式:
D. 乙烯的结构式:
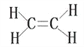
难度: 简单查看答案及解析
-
下列有机物实际存在且命名正确的是
A.2,2-二甲基丁烷 B.2-甲基-5-乙基-1-己烷
C.3-甲基-2-丁烯 D.3,3-二甲基-2-戊烯
难度: 简单查看答案及解析
-
主链上含5个碳原子,有甲基、乙基2个支链的烷烃有
A. 2种 B. 3种 C. 4种 D. 5种
难度: 简单查看答案及解析
-
下列物质中,不能用酸性KMnO4溶液鉴别,但可用溴水鉴别的是
A.己烷 苯 B.己烯 苯
C.己烯 甲苯 D.己烷 己烯
难度: 中等查看答案及解析
-
已知:
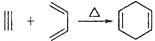 ,如果要合成
,如果要合成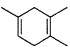 ,所用的原始原料可以是
,所用的原始原料可以是A.3-甲基-l,3-丁二烯和3-丁炔
B.1,3-戊二烯和2-丁炔
C.2,3-二甲基-1,3-戊二烯和乙炔
D.2,3-二甲基-l,3-丁二烯和丙炔
难度: 中等查看答案及解析

 RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。
RCHO+R’CHO,请写出下列反应产物的结构简式:___________________。