-
工业酸性废水中的Cr2O72-可转化为Cr3+除去,实验室用电解法模拟该过程,结果如下表所示(实验开始时溶液体积为50 mL,Cr2O72-的起始浓度、电压、电解时间均相同)。下列说法中,不正确的是( )
实验
①
②
③
电解条件
阴、阳极均为石墨
阴、阳极均为石墨,滴加1 mL浓硫酸
阴极为石墨,阳极为铁,滴加1 mL浓硫酸
Cr2O72-的去除率/%
0.922
12.7
57.3
A. 对比实验①②可知,降低pH可以提高Cr2O72-的去除率
B. 实验②中,Cr2O72-在阴极放电的电极反应式是Cr2O72- + 6e-+ 14H+ == 2Cr3+ + 7H2O
C. 实验③中,Cr2O72-去除率提高的原因是阳极产物还原Cr2O72-
D. 实验③中,理论上电路中每通过3 mol电子,则有0.5 mol Cr2O72- 被还原
难度: 中等查看答案及解析
-
化学与生活、生产、科技密切相关。下列说法错误的是( )
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.服用维生素C可缓解亚硝酸盐中毒,利用了维生素C的酸性
C.研发新能源汽车,减少化石燃料的使用,与“绿水青山就是金山银山”的绿色发展理念一致
D.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
难度: 简单查看答案及解析
-
下列有关化学现象和化学概念表述正确的是
A.由于四氯化碳的沸点高,所以四氯化碳可用于灭火
B.Fe(OH)3胶体做电泳实验时,由阴极区红色加深可知Fe(OH)3胶体带正电荷
C.鉴定FeCl3溶液中含有FeCl2可以滴加酸性KMnO4溶液,若褪色,则证明有FeCl2
D.1mol H3PO3最多可与2 mol NaOH发生中和反应,因此Na2HPO3属于正盐
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A. 22.4LCl2溶于足量水,所得溶液中Cl2、Cl-、HClO和ClO-四种微粒总数为NA
B. 标准状况下,38g3H2O2中含有3NA共价键
C. 常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D. 0.1mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA
难度: 中等查看答案及解析
-
下列有关热化学方程式的叙述正确的是
A.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B.已知C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1,则金刚石比石墨稳定
C.含0.5 mol NaOH的稀溶液与稀醋酸完全中和,放出26.7 kJ的热量,则表示该反应中和热的热化学方程式为OH-(aq)+H+(aq)=H2O(l) ΔH=-53.4 kJ·mol-1
D.已知2H2S(g)+O2(g)=2S(g)+2H2O(l) ΔH1、2H2S(g)+3O2(g)=2SO2(g)+2H2O(l) ΔH2,则ΔH1>ΔH2
难度: 简单查看答案及解析
-
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2 ,下列说法不正确的是
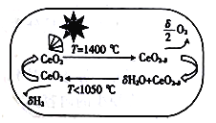
A.太阳能最终转变为化学能 B.T<1050℃时,CeO2-δ比CeO2稳定
C.CeO2是水分解的催化剂 D.两步反应均属于氧化还原反应
难度: 中等查看答案及解析
-
有关物质结构的下列说法中正确的是( )
A.石油裂解只破坏极性键
B.含极性键的共价化合物一定是电解质
C.氯化钠固体中的离子键在溶于水时被破坏
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
难度: 简单查看答案及解析
-
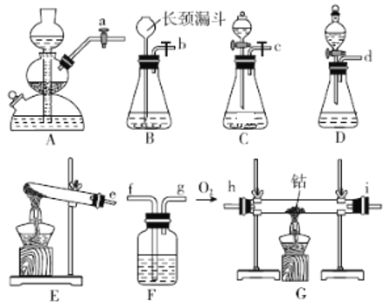
下列实验装置或操作正确的是
A.从碘水中分离出碘
 B.除去CO中的CO2
B.除去CO中的CO2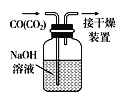
C.检验溶液中NH4+的存在
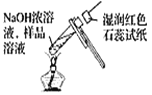 D.
D.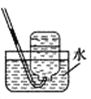 收集HCl气体
收集HCl气体难度: 简单查看答案及解析
-
化学与社会生活密切相关,对下列现象或事实的叙述及解释均正确的是
选项
现象或事实
解释
A
SO2的水溶液中加入紫色石蕊溶液,先变红,后褪色
先变红是因为亚硫酸显酸性,后褪色是因为SO2有漂白性
B
漂白粉中滴加浓盐酸会增强漂白性
漂白粉中的Ca(ClO)2与HCl反应生成HClO的原因
C
往红色的Fe(SCN)3溶液中滴加新制的氯水,红色褪去
因为新制的氯水有强氧化性,能将SCN-氧化而使之褪色
D
Fe2O3可与CO反应制取单质Fe
CO具有还原性,能把Fe置换出来
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关物质的性质与用途说法正确的是
A.胶体的胶粒带电,利用这一性质可进行“血液透析”和“静电除尘”
B.CaO能与SO2反应,可作工业废气脱硫剂
C.NaHCO3能与碱反应,因此食品工业上可用作焙制糕点的膨松剂
D.SO2和湿润的O3都有漂白性,混合后得到漂白性更强的漂白剂
难度: 中等查看答案及解析
-
已知CuO经高温灼烧生成Cu2O,Cu2O与H+发生反应:Cu2O+2H+===Cu+Cu2++H2O。将经高温灼烧后的CuO样品投入足量的热的稀硝酸溶液中,下列有关说法中正确的是( )
A.如果溶液变为蓝色,同时有紫红色固体出现,说明样品全部生成Cu2O
B.溶液中最终可能有紫红色固体出现
C.该实验的结果无法说明CuO分解的程度
D.如果溶液中出现蓝色,最终没有紫红色固体出现,说明CuO没有分解
难度: 中等查看答案及解析
-
浓硫酸分别和三种钠盐反应,下列分析正确的是
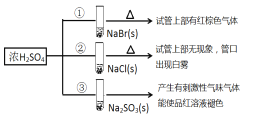
A.对比①和②可以说明还原性Br->Cl-
B.①和③相比可说明氧化性Br2>SO2
C.②中试管口白雾是HCl遇水蒸气所致,说明酸性H2SO4>HCl
D.③中浓H2SO4被还原成SO2
难度: 中等查看答案及解析
-
依据所给条件推出的结论不正确的是( )
选项
条件
结论
A
在水溶液或熔融状态下可以导电的化合物,称为电解质
水中存在:
,因此,水是电解质
B
凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱
既是酸又是碱
C
联氨为二元弱碱,在水中的电离方式与氨相似
联氨与硫酸形成的酸式盐的化学式为:
D
发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱
,在该反应中,
是碱
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列实验方案正确且能达到实验目的的是( )
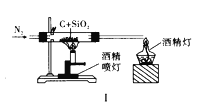
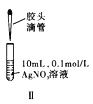

A. 图Ⅰ比较碳、硅两元素非金属性的强弱
B. 图Ⅱ先滴加5滴
的
溶液,再滴加5滴
的
溶液。比较
与
溶解度的大小
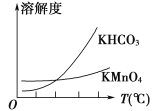
C. 图Ⅲ已知溶解度(20℃)
:
;
:
。室温下,比较
和
溶解度的大小
D. 图Ⅳ证明碳酸的酸性比硅酸强
难度: 中等查看答案及解析
-
全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是
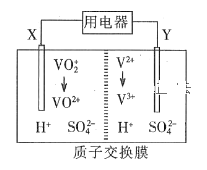
A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
难度: 中等查看答案及解析
-
下图是另一种元素周期表的一部分,下列说法正确的是( )
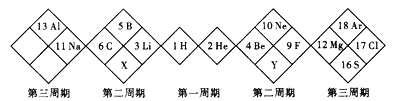
A. X的氢化物只有极性键,Y的氢化物可能既含有极性键,又含有非极性键
B. X的最高价氧化物对应的水化物为弱酸
C. X、Y的原子半径和单核离子半径均为前者大于后者
D. 由于Y氢化物的熔沸点高于X氢化物的熔沸点,因此,非金属性:
难度: 中等查看答案及解析
-
X、Y、Z、W为短周期主族元素,25℃时,其最高价氧化物对应的水化物(浓度均为0.01mol·L-1)溶液的pH和原子序数的关系如图所示。下列有关说法不正确的是( )

A.四种元素形成的简单离子半径最小的为X
B.Y和Z形成的Y2Z2型化合物中含离子键和共价键
C.可用中和滴定的方法来测定Z的最高价氧化物对应水化物的浓度
D.四种元素均可形成氢化物
难度: 中等查看答案及解析
-
由硫铁矿烧渣(主要成分:Fe3O4、Fe2O3和FeO)得到绿矾(FeSO4·7H2O),再通过绿矾制备铁黄[FeO(OH)]的流程如下:
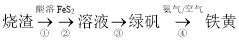
已知:FeS2和铁黄均难溶于水。下列说法错误的是( )
A.步骤①后可依次用KSCN溶液和酸性KMnO4溶液来检测溶液中铁元素的价态
B.步骤②发生后,溶液的酸性增强
C.步骤③,将溶液蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥可得到绿矾
D.为确保铁黄的产率,尽可能将步骤④中的pH值调大
难度: 中等查看答案及解析
-
向一定量的Cu、Fe2O3的混合物中加入400 mL 1 mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含Fe3+。若用过量的CO在高温下还原相同质量的原混合物,固体减少的质量为
A. 2.4 g B. 3.2 g C. 4.8 g D. 6.4 g
难度: 困难查看答案及解析