-
氧化还原反应与四种基本类型反应的关系如下图所示,则下列化学反应属于图中阴影部分的是( )
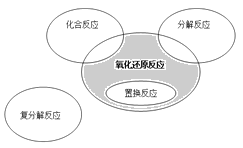
A.4Fe(OH)2+O2+2H2O== Fe(OH)3
B.2NaHCO3
Na2CO3+H2O+CO2↑
C.4NH3+5O2
4NO+6H2O
D.Zn+H2SO4=ZnSO4+H2↑
难度: 中等查看答案及解析
-
下列各组化合物中,均为弱电解质的组是( )
A.H2CO3、Ba(OH)2、K2S、H3PO4 B.FeCl3、HF、CH3CH2OH、NH4Cl
C.CH3COOH、H2S、NH3H2O、H2O D.HClO、H2SO3、HCl、NaHCO3
难度: 简单查看答案及解析
-
下列说法错误的是( )
A.“血液透析”利用了胶体的性质
B.溶液是电中性的,胶体是带电的
C.明矾能水解生成Al(OH)3胶体,可用作净水剂
D.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法不正确的是
A.标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为NA
B.同温同压下,体积相同的氢气和氩气所含的分子数相等
C.78gNa2O2与足量的CO2反应转移电子数为NA
D.1L 2mol/L的氯化镁溶液中含氯离子为2NA
难度: 简单查看答案及解析
-
下列实验装置不能达到实验目的的是( )
A.验证Na和水反应是否为放热反应:
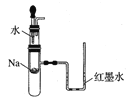
B.检验Na2O2与H2O反应有O2生成:
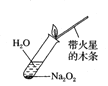
C.观察纯碱的焰色反应:
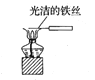
D.比较Na2CO3、NaHCO3的稳定性:
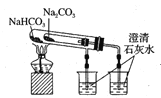
难度: 中等查看答案及解析
-
中国传统文化对人类文明贡献巨大,古代文献中充分记载了古代化学研究成果,我国晋代《抱朴子》中描述了大量的化学反应,其中有①“丹砂烧之成水银,积变又成丹砂”;②“以曾青涂铁,铁赤色如铜”,下列有关叙述正确的是( )(已知丹砂化学式为HgS)
A.①中水银“积变又成丹砂”说明水银发生了还原反应
B.②中反应的离子方程式为2Fe+3Cu2+=2Fe3++3Cu
C.根据①可知温度计打破后可以用硫粉覆盖水银,防止中毒
D.水银能跟曾青发生置换反应生成单质铜
难度: 中等查看答案及解析
-
在溶液中,0.2 mol
恰好能使0.4 mol
被完全氧化成
,则
被还原后X元素的化合价为( )
A.+1 B.+2 C.+3 D.+4
难度: 简单查看答案及解析
-
下列对于过氧化钠的叙述中,正确的是
A.将少量Na2O2投入紫色石蕊溶液中,溶液最终呈蓝色
B.1 mol Na2O2与H2O完全反应,转移2 mol电子
C.Na2O2和Na2O均属碱性氧化物
D.Na2O2与CO2反应时,Na2O2既作氧化剂,又作还原剂
难度: 简单查看答案及解析
-
超临界状态下的CO2流体溶解性与有机溶剂相似,可提取中药材的有效成分,工艺流程如下。
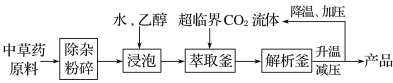
下列说法中错误的是( )
A.浸泡时加入乙醇有利于中草药有效成分的浸出
B.高温条件下更有利于超临界CO2流体萃取
C.升温、减压的目的是实现CO2与产品分离
D.超临界CO2流体萃取中药材具有无溶剂残留、绿色环保等优点
难度: 中等查看答案及解析
-
能正确表示下列化学反应的离子方程式的是( )
A.硫酸铜溶液与氢氧化钡溶液反应:Ba2++
=BaSO4↓
B.将NaHSO4溶液滴入Ba(OH)2溶液中至溶液呈中性:2H++
+2OH-+Ba2+=BaSO4↓+2H2O
C.足量CO2通入澄清石灰水中:2OH-+CO2=H2O+
D.碳酸氢钙溶液与足量氢氧化钠溶液反应:Ca2++
+OH-=CaCO3↓+H2O
难度: 中等查看答案及解析
-
无色透明的某强酸性溶液中能大量共存的离子组是
A.Na+、Mg2+、Cl-、OH- B.Ca2+、K+、Cl-、NO3-
C.Cu2+、K+、SO42-、NO3- D.Na+、HCO3-、OH-、Al3+
难度: 简单查看答案及解析
-
关于电解质,下列说法正确的是( )
A.强电解质的水溶液中不存在分子
B.氨气溶于水能导电,所以氨气是电解质
C.H2SO4是强电解质,但在熔融状态下不能导电
D.盐酸能导电的原因是溶液在通电作用下产生了自由移动的离子
难度: 简单查看答案及解析
-
在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢为原料制取氧气,当制得相同物质的量的氧气时,三个反应中转移的电子数之化为( )
A.1:1:1 B.2:2:1 C.2:3:1 D.4:3:2
难度: 简单查看答案及解析
-
已知I-、Fe2+、SO2、Cl- 和H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为Cl-<Fe2+<H2O2<I-<SO2,则下列反应中不能发生的是( )
A.H2O2+H2SO4══SO2↑+O2↑+2H2O
B.I2+SO2+2H2O══H2SO4+2HI
C.2Fe2++Cl2══2Fe3++2Cl-
D.2Fe3++SO2+2H2O══2Fe2++SO42-+4H+
难度: 困难查看答案及解析
-
检验某溶液中是否含有
,常用的方法是( )
A.取样,滴加BaCl2溶液,看是否有不溶于水的白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有不落于水的白色沉淀生成
C.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有不落于水的白色沉淀生成
D.取样,滴加稀盐酸,无明显现象,再滴加BaCl2落液,看是否有不溶于水的白色沉淀生成
难度: 简单查看答案及解析