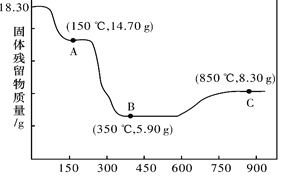
-
2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
难度: 中等查看答案及解析
-
下列制备金属单质的方法或原理正确的是( )
A. 在高温条件下,用H2还原MgO制备单质Mg
B. 在通电条件下,电解熔融Al2O3制备单质Al
C. 在通电条件下,电解饱和食盐水制备单质Na
D. 加强热,使CuO在高温条件下分解制备单质Cu
难度: 中等查看答案及解析
-
下列叙述正确的是
A. 漂白粉、水玻璃、冰醋酸都是混合物
B. 金属氧化物一定是碱性氧化物
C. 根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D. 氨气、水和硫酸钡分别属于非电解质、弱电解质和强电解质
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述不正确的是( )
A.标准状况下,22.4L CO2与CO的混合气体中含碳原子数目为NA
B.常温下,1L 0.1 mol·L-1的NH4NO3溶液中NH4+数目为0.1NA
C.2.7g金属铝变为铝离子时失去的电子数目为0.3NA
D.室温下,21g C2H4和C4H8的混合气体中含有的原子数目为4.5 NA
难度: 中等查看答案及解析
-
已知4NH3(g)+5O2(g)
4NO(g)+6H2O(g),若反应速率分别用v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系式为
A.4v(NH3)=5v(O2) B.5v(O2)=6v(H2O)
C.2v(NH3)=3v(H2O) D.4v(O2)=5v(NO)
难度: 简单查看答案及解析
-
下列各项操作或现象能达到预期实验目的的是
选项
操作或现象
实验目的
A
将铁钉放入试管中,用盐酸浸没
验证铁的吸氧腐蚀
B
向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色
证明Br—还原性强于Cl—
C
将氯化亚铁固体溶于适量蒸馏水中
配制FeCl2溶液
D
将混有氯化氢杂质的氯气通过装有饱和NaHCO3溶液的洗气瓶
除去氯气中的HCl气体
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在下列溶液中,各组离子一定能够大量共存的是:( )
A.使酚酞试液变红的溶液: Na+、Cl-、SO42-、Fe3+
B.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C.c(H+)=10-12mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D.碳酸氢钠溶液:K+、SO42-、Cl-、H+
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W在元素周期表中的相对位置如下表所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是( )
Y
Z
X
W
A.原子半径:X<Y<Z
B.气态氢化物的稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物对应水化物的酸性:Y>W
难度: 中等查看答案及解析
-
Na2FeO4是一种高效多功能水处理剂,应用前景十分看好。一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2O2 ===2Na2FeO4 +2Na2O+2Na2SO4 +O2↑,对此反应下列说法中正确的是
A.Na2O2只作氧化剂
B.2 mol FeSO4发生反应时,反应中共有8 mol电子转移
C.每生成22.4L氧气就有2 mol Fe2+ 被氧化
D.Na2FeO4既是还原产物又是氧化产物
难度: 困难查看答案及解析
-
下列关于化学键的说法正确的是( )
A.C、N、O、H四种元素形成的化合物一定既有离子键,又有共价键
B.不同元素的原子构成的分子不一定只含极性共价键
C.含极性键的共价化合物一定是电解质
D.HF的分子间作用力大于HCl,故HF比HCl更稳定
难度: 简单查看答案及解析
-
进行下列实验,相关说法正确的是
A.图
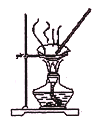 :蒸干NH4Cl饱和溶液制备NH4Cl晶体
:蒸干NH4Cl饱和溶液制备NH4Cl晶体B.图
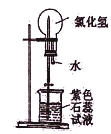 :形成美丽的红色喷泉,证明HC1极易溶于水
:形成美丽的红色喷泉,证明HC1极易溶于水C.图
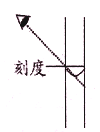 :配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低
:配制一定物质的量浓度的NaOH溶液,定容时如图则所配NaOH溶液浓度偏低D.图
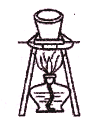 :所示装置用于除去碳酸氢钠固体中的少量碳酸钠
:所示装置用于除去碳酸氢钠固体中的少量碳酸钠难度: 困难查看答案及解析
-
已知反应:H2(g)+
O2(g)=H2O(g) ΔH1
N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3 B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3 D. 3ΔH1+2ΔH2-2ΔH3
难度: 中等查看答案及解析
-
已知外电路中,电子由铜流向a极。有关下图所示的装置分析合理的一项是
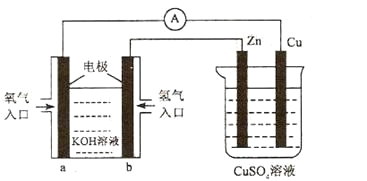
A.该装置中Cu极为正极
B.当铜极的质量变化为12 .8g时,a极上消耗的O2在标准状况下的体积为2.24L
C.b极反应的电极反应式为:H2-2e-=2H+
D.一段时间后锌片质量减少
难度: 中等查看答案及解析
-
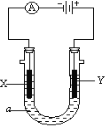
如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和稀盐酸,各加入生铁块,放置一段时间。下列有关描述错误的是( )
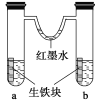
A.生铁块中的碳是原电池的正极
B.红墨水柱两边的液面变为左低右高
C.两试管中相同的电极反应式是:
D.a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
难度: 中等查看答案及解析
-
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨和锂,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是( )
A.放电时电池正极反应为:FePO4+Li++e-=LiFePO4
B.放电时电池内部Li+向负极移动
C.充电过程中,电池正极材料的质量增加
D.可加入硫酸以提高电解质的导电性
难度: 困难查看答案及解析
-
2017年9月我国科学家对于可充放电式锌一空气电池研究取得重大进展。电池装置如图所示,该电池的核心是驱动氧化还原反应(ORR)和析氧反应(OER),KOH溶液为电解质溶液,放电的总反应方程式为2Zn+O2+40H-+2H2O=2Zn(OH)2。下列有关说法正确的是( )
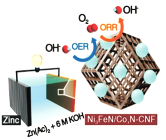
A.可逆锌一空气电池实际上是二次电池,放电时电解质溶液中K+向负极移动
B.在电池产生电力的过程中,空气进入电池,发生ORR反应,并释放OH-
C.发生OER反应的电极反应式为2H2O-4e-=O2+4H+
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
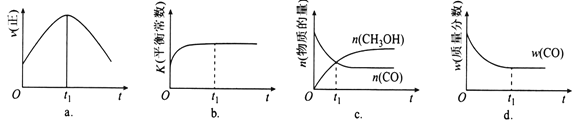
臭氧在烟气脱硝中的反应为2NO2(g)+O3(g)
N2O5(g)+O2(g)。若此反应在恒容密闭容器中进行,相关图像如下,其中对应分析结论正确的是( )
A.
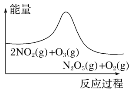 平衡后降温,NO2含量降低
平衡后降温,NO2含量降低B.
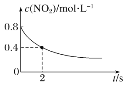 0~2 s内,υ(O3)=0.2 mol·L-1·s-1
0~2 s内,υ(O3)=0.2 mol·L-1·s-1C.
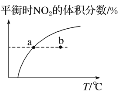 υ正:b点<a点,b点:υ逆<υ正
υ正:b点<a点,b点:υ逆<υ正D.
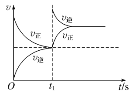 恒温,t1时再充入O3
恒温,t1时再充入O3难度: 中等查看答案及解析
-
某溶液中可能含有OH-、CO32-、[Al(OH)4]-、SiO32-、SO42-、Na+、Fe3+、Mg2+、Al3+等离子。当向该溶液中逐滴加入一定物质的量浓度的盐酸时,发现生成沉淀的物质的量随盐酸溶液的体积变化如图所示。下列说法正确的是
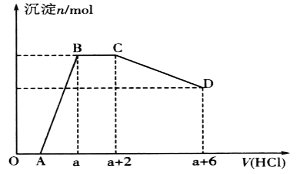
A.BC段是OH-与盐酸反应
B.反应后最终溶液中的溶质只有NaC1
C.原溶液中含有CO32-与[Al(OH)4]-的物质的量之比为3:4
D.原溶液中一定含有的离子是Na+、OH-、SiO32-、SO42-、[A1(OH)4]-、CO32-
难度: 困难查看答案及解析