-
化学与生产、生活、社会密切相关,下列有关说法不正确的是
A. 食品透气袋里放入盛有硅胶和铁粉的小袋,可防止食物受潮、氧化变质
B. 草木灰和铵态氮肥不能混合使用,是因为NH4+与CO32﹣能发生双水解反应
C. 明矾和漂白粉可用于自来水的净化,但两者的作用原理不相同
D. 在次氯酸钠溶液中通入少量二氧化硫可使其消毒能力增强
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数值,下列说法正确的是
A. 1 L 0.5 mol/L NaHCO3溶液中HCO3-和CO32-数目之和小于0.5 NA
B. 11.2 g 铁粉与硝酸反应失去电子数一定为0.6 NA
C. 25℃ 时,pH=13的 Ba(OH)2溶液中含有的OH﹣数目为0.2 NA
D. 46 g甲苯含有C=C双键的数目为1.5 NA
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是
A. 葡萄糖与果糖、淀粉与纤维素均互为同分异构体
B.
的同分异构体中含有苯环且属于羧酸的有8种
C. 2,2-二甲基丙烷可以由烯烃通过加成反应制得
D. 汽油、柴油、植物油都是碳氢化合物
难度: 困难查看答案及解析
-
短周期元素Q、R、T、W在周期表中的位置如图所示,其中,T所处周期序数与主族序数相等,则下列说法正确的是
A. 元素R的最高价氧化物对应的水化物是高沸点酸
B. 元素T和W各自形成的简单离子都能促进水的电离
C. 简单离子半径:W>T>R
D. 常温下,T的单质能完全溶于R的最高价氧化物的水化物的浓溶液中
难度: 困难查看答案及解析
-
下列说法正确的是
A. 升高NH4Cl溶液的温度,其水的离子积常数和pH均增大
B. 在有AgI沉淀的上层清液中滴加一定浓度的NaCl溶液,不可能产生白色沉淀
C. pH=3的盐酸与pH=11的氨水等体积混合后,溶液中:c(NH4+>c(Cl-)>c(OH-)>c(H+)
D. 室温下,稀释
溶液,溶液的导电能力增强
难度: 困难查看答案及解析
-
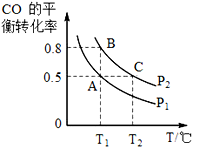
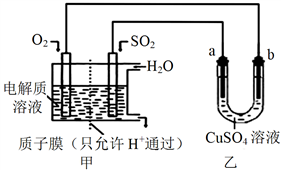
H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是
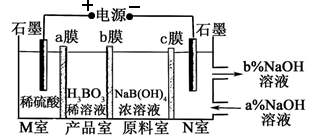
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴离子交换膜
D. 理论上每生成1mol产品,阴极室可生成5.6L气体
难度: 困难查看答案及解析
-
下列实验方案正确且能达到预期目的的是
选项
实验方案
实验目的或结论
A
将H2SO4酸化的H2O2滴入Fe(NO3)2溶液中,溶液变黄色
氧化性:H2O2比Fe3+强
B
将SO2通入酸性高锰酸钾溶液中
SO2具有漂白性
C
取a g铝箔与足量氢氧化钠溶液充分反应,逸出的气体通过浓硫酸后,测其体积为V L(标况)
测定铝箔中氧化铝的含量
D
比较不同反应的反应热数据大小
判断反应速率大小
A. A B. B C. C D. D
难度: 困难查看答案及解析
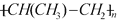 ,该反应中涉及的物质中碳原子的杂化轨道类型有______________;反应中涉及的元素中电负性最大的是______________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________________。
,该反应中涉及的物质中碳原子的杂化轨道类型有______________;反应中涉及的元素中电负性最大的是______________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是__________________。
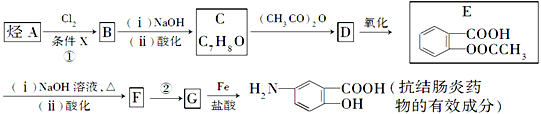
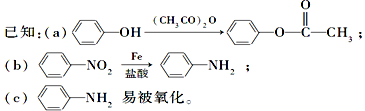
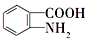 的路线(仿照题中抗结肠炎药物的有效成分的合成路线进行答题) ________________。
的路线(仿照题中抗结肠炎药物的有效成分的合成路线进行答题) ________________。