-
为检验某溶液中是否含有Fe3+,可以选择的试剂是( )
A. KSCN溶液 B. AgNO3溶液 C. 酸性KMnO4溶液 D. BaCl2溶液
难度: 简单查看答案及解析
-
某物质A的实验式为CoCl3·4NH3,1molA中加入足量的AgNO3溶液中能生成1mol白色沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法中正确的是
A.Co3+只与NH3形成配位键
B.配合物配位数为3
C.该配合物可能是平面正方形结构
D.此配合物可写成[Co(NH3)4 Cl2] Cl
难度: 中等查看答案及解析
-
反应4A(s)+3B(g)=2C(g)+D(g),经2min后B的浓度减少0.6 mol/L。对此反应速率的正确表示是( )
A. 用A表示的反应速率是0.4 mol/(L·min)
B. 用B、C、D分别表示反应的速率,其比值是3:2:1
C. 在2min末的反应速率用B表示是0.3 mol/ (L·min)
D. 反应过程中B、C的反应速率关系:3v(B)=2v(C)
难度: 简单查看答案及解析
-
下列有关电解质的说法正确的是( )
A.强电解质的溶液一定比弱电解质的溶液导电性强
B.强电解质的溶液中只有阴、阳离子
C.离子化合物都是强电解质,而弱电解质都是共价化合物
D.由于硫酸钡难溶于水,所以是弱电解质
难度: 简单查看答案及解析
-
以下是一些常用危险化学品的标志,水银应贴的危险化学品标志是




A.遇湿易燃物品 B.易燃液体 C.氧化剂 D.剧毒品
难度: 简单查看答案及解析
-
从不含杂质的氯化钠溶液中获得氯化钠晶体,采用的操作是
A.
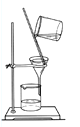 B.
B. C.
C.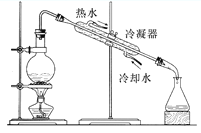 D.
D.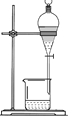
难度: 中等查看答案及解析
-
如图是一定条件下某化学反应的反应速率随反应时间变化 的示意图.下列叙述与示意图不相符合的是( )
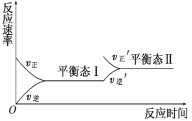
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.同一种反应物在平衡态Ⅰ和平衡态Ⅱ时浓度不相等
D.该反应达到平衡态Ⅰ后,升高温度正反应速率加快,逆反应速率减慢
难度: 简单查看答案及解析
-
下列说法不正确的是
A.葡萄糖、蔗糖、淀粉和纤维素均属于糖类
B.酶是一种具有高选择催化性能的蛋白质
C.硬脂酸甘油酯属于高级脂肪酸甘油酯,是高分子化合物
D.动物脂肪和氢氧化钠混合加热,可得到肥皂的主要成分和甘油
难度: 简单查看答案及解析
-
S-诱抗素的分子结构如图。下列关于该物质的说法正确的是
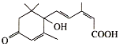
A.该有机物能发生取代、加成和水解反应 B.1mol该有机物与足量溴反应最多消耗4mol Br2
C.该有机物的分子式为C15H21O4 D.1mol该有机物与足量Na反应生成生成1mol H2
难度: 简单查看答案及解析
-
化合物
(甲)、
(乙)、
(丙)的分子式均为
,下列说法正确的是( )
A.甲的同分异构体只有乙和丙两种
B.甲、乙、丙的一氯代物种数最少的是丙
C.甲、乙、丙均可与溴的四氯化碳溶液反应
D.甲中所有原子可能处于同一平面
难度: 中等查看答案及解析
-
下列关于盐酸与醋酸两种稀溶液的说法正确的是( )
A.相同浓度的两溶液中c(H+)相同
B.pH=3的两溶液稀释100倍,pH都为5
C.100 mL 0.1 mol·L-1的两溶液能中和等物质的量的氢氧化钠
D.两溶液中分别加入少量对应的钠盐,c(H+)均明显减小
难度: 中等查看答案及解析
-
数据:7.2×10﹣4、4.6×10﹣4、4.9×10﹣10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:①NaCN+HNO2===HCN+NaNO2,②NaCN+HF====HCN+NaF,③NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10﹣4
B.HNO2的电离平衡常数为4.9×10﹣10
C.根据①③两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
难度: 中等查看答案及解析
-
室温下,相同浓度和体积的盐酸和醋酸溶液,下列说法正确的( )
A.两者水的电离程度相同
B.与足量的锌反应盐酸产生的氢气多
C.盐酸的c(H+)大于醋酸溶液的c(H+)
D.分别与物质的量浓度相同的NaOH溶液恰好反应完全时,盐酸消耗NaOH溶液的体积多
难度: 简单查看答案及解析
-
常温下将稀NaOH溶液和稀CH3COOH溶液混合,不可能出现的结果是 ( )
A.pH>7,且c(OH-)>c(Na+)>c(H+)>c(CH3COO-)
B.pH>7,且c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
C.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
甲酸是一元有机酸。室温下,下列事实不能说明它是弱电解质的是( )
A.0.1 mol•L﹣1 HCOONa溶液的pH大于7
B.1mol•L﹣1甲酸溶液的pH值约为2
C.10mL 1mol•L﹣1甲酸恰好与10mL 1mol•L﹣1NaOH溶液完全反应
D.相同条件下,浓度均为0.1 mol•L﹣1甲酸溶液和盐酸,甲酸溶液的导电能力弱
难度: 简单查看答案及解析
-
常温下,下列溶液中,有关微粒物质的量浓度关系正确的是
A.0.1mol·L−1 (NH4)2Fe(SO4)2溶液:c(SO42-)>c(NH4+)>c(H+)>c(Fe2+)
B.将100mL0.1mol·L−1 Na2CO3溶液逐滴滴加到100mL0.1mol·L−1盐酸中:c(Na+)>c(Cl−)>c(HCO3-)>c(CO32-)
C.pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后:c(CH3COO−)>c(Na+)>c(H+)>c(OH−)
D.0.1mol·L−1NaHCO3溶液:c(H+)+2c(H2CO3)=c(OH−)+c(CO32-)
难度: 中等查看答案及解析
-
下列溶液中各微粒的浓度关系或说法正确的是( )
A.0.1 mol•L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
B.等物质的量浓度的下列溶液中,①NH4Al(SO4)2 ②NH4Cl ③CH3COONH4 ④NH4HCO3 ⑤NH4HSO4 ⑥NH3·H2O;c(NH4+) 由大到小的顺序是:⑤>①>②>④>③>⑥
C.向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
D.0.1mol·L-1的氨水的pH=a,0.01mol·L-1的氨水的pH=b,则a=b+1
难度: 中等查看答案及解析
-
常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CH3COO-)
C.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
在恒容密闭容器中,可逆反应C(s)+CO2(g)
2CO(g)达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC
②单位时间内生成n molCO2 的同时生成2n mol CO
③CO2 、CO的物质的量浓度之比为1: 2的状态
④混合气体的密度不再改变的状态
⑤混合气体的压强不再改变的状态
⑥C的质量不再改变的状态
A.①④⑤⑥ B.②④⑤⑥ C.②③⑤⑥ D.①②③④
难度: 中等查看答案及解析
-
已知:pAg=-lgc(Ag+),Ksp(AgCl)=1×10-12,Ksp (AgI)=1×10-16。如图是向10mLAgNO3溶液中逐滴滴入0.1mo1·L-1的NaCl溶液时,pAg随着加入NaCl溶液的体积变化的图像(实线)。下列叙述正确的是

A. 原AgNO3溶液的物质的量浓度为0.1mol·L-1
B. 图中x点表示溶液中Ag+恰好完全沉淀
C. 图中x点的坐标为(10,6)
D. 若把NaCl溶液换成0.1mol·L-1NaI溶液,则图像在终点后变为虚线部分
难度: 简单查看答案及解析
-
已知常温时CH3COOH的电离平衡常数为K。该温度下向20 mL 0.1 mol·L-1 CH3COOH溶液中逐滴加入0.1 mol·L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
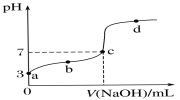
A.a点表示的溶液中c(H+)等于10-3 mol·L-1
B.b点表示的溶液中c(CH3COO-)>c(Na+)
C.c点表示CH3COOH和NaOH恰好反应完全
D.b、d点表示的溶液中
均等于K
难度: 困难查看答案及解析
-
某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),正确的是( )
①常温下,pH=1的强酸溶液,加水稀释后,溶液中离子浓度均降低
②pH=2的盐酸和pH=1的盐酸,c(H+)之比为2:1
③pH相等的四种溶液:a.CH3COONa;b.NaClO;c.NaHCO3;d.NaOH。其溶液物质的量浓度由小到大顺序为d、b、c、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)= 2c(SO42-)
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw;则三者关系为Ka·Kh=Kw
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7
A.①②④ B.③④⑥ C.④⑤⑥ D.③⑤⑥
难度: 中等查看答案及解析


