-
下列对“摩尔(mol)”的叙述不正确的是 ( )
A.摩尔是一个单位,用于计量物质所含微观粒子的多少
B.摩尔既能用来计量纯净物,又能用来计量混合物
C.1 mol任何气体所含的气体分子数目都相等
D.用“摩尔”(而不用“个”)计量微观粒子与用“纳米”(而不用“米”)计量原子直径,计量思路都是扩大单位
-
将30 mL 0.5mol/L的NaOH溶液加水稀释到500 mL,稀释后NaOH的物质的量浓度为( )
A.0.3 mol/L B.0.03 mol/L C.0.05 mol/L D.0.04 mol/L
-
在某无色透明的酸性溶液中,能共存的离子组是
A.Na+ 、K+、SO42-、HCO3- B.Cu2+、K+、SO42-、NO3-
C.Na+、 K+、Cl-、 NO3- D.Fe3+、K+、SO42-、Cl-
-
下列溶液与20mL 1 mol·L-1 NaNO3溶液中NO3-物质的量浓度相等的是( )
A.10 mL 1 mol·L-1 Mg(NO3)2溶液 B.5 mL 0.8 mol·L-1 Al(NO3)3溶液
C.10 mL 2 mol·L-1 AgNO3溶液 D.10 mL 0.5 mol·L-1 Cu(NO3)2溶液
-
实验室进行过滤和蒸发操作时,都要用到的仪器是 ( )
A. 烧杯 B. 玻璃棒
C. 蒸发皿 D. 酒精灯
-
下列实验操作中都正确的选项是 ( )
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④浓硫酸的稀释时,将水沿烧杯内壁缓缓倒入,并不断搅拌
A.②③ B.②③④ C.②④ D.①②③④
-
下列有关实验的叙述正确的是( )
A.用分液的方法分离水和酒精的混合物
B.进行分液时,分液漏斗中的上层液体上口倒出,下层液体下口流出
C.配制NaCl溶液时可用托盘天平称量5.85gNaCl固体
D.用滴管滴加液体时,为防止液滴溅出,滴管紧贴试管内壁
-
在盛有碘水的试管中,加入少量 后振荡,静置片刻后( )
后振荡,静置片刻后( )
A.整个溶液变紫色 B.整个溶液变为棕黄色
C.上层几乎无色,下层为紫红色 D.下层无色,上层紫红色
-
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是( )
A.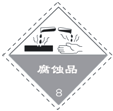 B.
B.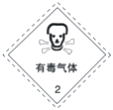
C. D.
D.
-
选择萃取剂将碘水中的碘萃取出来,这中萃取剂应具备的性质是( )
A.不溶于水,且必须易与碘发生化学反应
B.不溶于水,且比水更容易使碘溶解
C.不溶于水,且必须比水密度大
D.不溶于水,且必须比水密度小
-
下列物质属于电解质的是( )
A.铜 B.食盐水 C.烧碱 D.蔗糖
-
下列化学方程式中,不能用离子方程式Ba2++SO42-=BaSO4↓表示的是( )
A.Ba(NO3)2 +H2SO4=BaSO4↓+2HNO3 B.BaCl2+Na2SO4=BaSO4↓+2NaCl
C.BaCO3+H2SO4=BaSO4↓+H2O+CO2↑ D.BaCl2+H2SO4=BaSO4↓+2HCl
-
下列说法正确的是( )
A.能电离出H+ 的化合物叫做酸
B.实验测得1mol某气体体积为22.4 L,测定条件一定是标准状况
C.摩尔是七个基本物理量之一
D.化合物分为酸、碱、盐和氧化物是用树状分类法分类的
-
同温同压下,同体积的甲乙两种气体的质量比是17:14。若乙气体是CO,则甲气体是
A. H2S B. HCl C. NH3 D. Cl2
-
下列各组物质,按化合物、单质、混合物顺序排列的是
A. 烧碱、液态氧、碘酒 B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢 D. 空气、氮气、胆矾
-
下列溶液,其中一种与其他三种均能发生离子反应,则这种物质是( )
A.H2SO4 B.KOH C.BaCl2 D.Na2CO3
-
1g N2中含有x个原子,则阿伏加德罗常数是( )
A.x/28 mol-1 B.x/14 mol-1 C.14x mol-1 D.28x mol-1
-
家庭中很多用品是大理石的,如饭桌,若食醋不慎滴在大理石桌面上,会使其失去光泽,变得粗糙,下列能解释此现象的是 ( )
A.醋中的水使大理石溶解 B.醋中的醋酸使大理石氧化
C.醋中的醋酸使大理石还原 D.醋中的醋酸和大理石发生了复分解反应
-
某元素在化学反应中,由化合态变为游离态,则该元素( )
A.一定被氧化 B.一定被还原
C.化合价降低为零价 D.可能被氧化,也可能被还原
-
在KClO3+ 6HCl(浓)= KCl + 3Cl2↑ + 3H2O 的反应中,氧化剂和还原剂的物质的量之比是
A.1:5 B.1 :6 C.5:1 D.6:1
 B.
B.
 D.
D.