-
纵观古今,化学与生活皆有着密切联系。下列说法错误的是
A.《本草图经》对绿矾记载:“此矾色绿,味酸,烧之则赤”。说明绿矾水溶液显酸性,固体灼烧有氧化铁生成
B.二硫化钼是一种新型有机功能材料,能作为导电、存储的二维材料
C.为汽车安装尾气催化转化装置,可将尾气中的部分CO和NO转化为无毒气体
D.石墨烯弹性气凝胶制成的碳海绵可用作处理原油泄漏的吸油材料
难度: 简单查看答案及解析
-
下列有关有机化合物的叙述,正确的是
A.淀粉、纤维素和油脂都属于天然高分子化合物
B.糖类、植物油和蚕丝在一定条件下都能够发生水解反应
C.石油的分馏所得的馏分一定都是纯净物
D.苯、乙醇、乙酸和乙酸乙酯在一定条件下都能发生取代反应
难度: 简单查看答案及解析
-
NA为阿伏伽德罗常数的值,下列说法错误的是
A.含2 mol H2SO4的浓硫酸与足量的锌完全反应,生成SO2分子数为NA
B.常温常压下,4.4g乙醛含有的原子数为0.7NA
C.100 mL 1mol/L的Na3PO4溶液中含有的离子数大于0.4 NA
D.1.8 g重水(D2O)中含有的质子数和电子数均为0.9NA
难度: 简单查看答案及解析
-
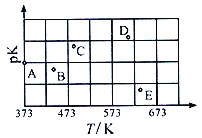
七种第三周期元素,其浓度均为0.01 mol·L-1的最高价氧化物对应水化物的pH与原子半径的关系如图所示。则下列说法正确的是
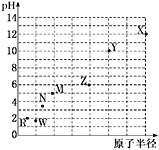
A.气态氢化物的稳定性:N>R
B.X和M两者最高价氧化物对应的水化物反应后溶液的pH>7
C.Z的最高价氧化物对应的水化物能溶于稀氨水
D.元素Y和R形成的化合物既含离子键又含共价键
难度: 中等查看答案及解析
-
由下列实验及现象推出相应结论正确的是
选项
实验
现象
结论
A
①某溶液中加入Ba(NO3)2溶液
②再加足量盐酸
①生白色沉淀
②仍有白色沉淀
原溶液中有SO42-
B
将含HCl的Cl2通过饱和食盐水
气体体积减小
可得到纯净的Cl2
C
将甲烷与氯气按体积比1:4混合于试管中光照
反应后的混合气体能使湿润的石试纸变红
生成的氯代甲烷具有酸性
D
将0.1mol/L MgSO4溶液滴入NaOH溶液至不再有沉淀产生,
再滴加0.1mol/L CuSO4溶液
先有白色沉淀生成,后转变为蓝色沉淀
Ksp[Cu(OH)2]<Ksp[Mg(OH)2]
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
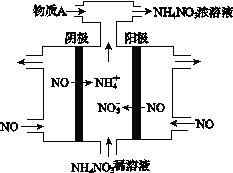
钠硫电池以熔融金属钠、熔融硫和多硫化钠(Na2Sx)分别作为两个电极的反应物,固体Al2O3陶瓷(可传导Na+)为电解质,其原理如图所示。下列说法正确的是
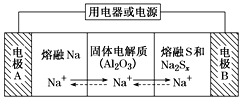
A.放电时,电极A为正极
B.充电时,Na+ 从电极A向电极B迁移
C.充电时,电极B反应式为S22-- 2e- === xS
D.该电池工作的适宜温度应控制在25 ℃左右
难度: 中等查看答案及解析
-
25℃时,向一定浓度的Na2X溶液中滴入盐酸,溶液的pH与离子浓度变化关系如图所示。
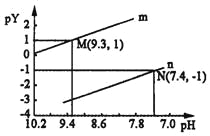
已知:H2X是二元弱酸,Y表示
或
,pY=﹣lgY.下列叙述不正确的是( )
A. 曲线n表示pH与p
的变化关系
B. Ka2(H2X)=1.0×10﹣10.3
C. NaHX溶液中c(H+)>c(OH﹣)
D. 当溶液呈中性时,c(Na+)=c(HX﹣)+2c(X2﹣)+c(Cl﹣)
难度: 困难查看答案及解析
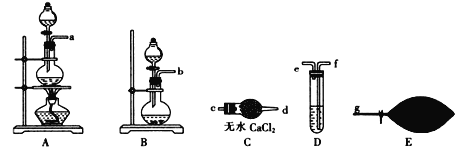
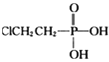 (乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。
(乙烯利)与NaOH溶液并用装置B制取乙烯,反应生成乙烯的化学方程式为(已知磷转化为Na3 PO4)_______________________。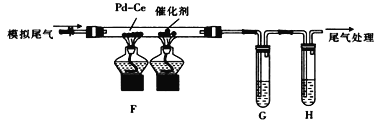
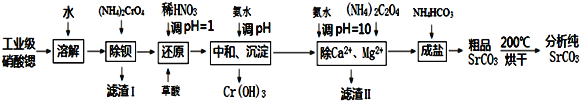
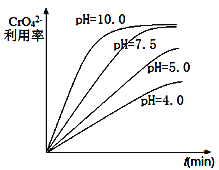

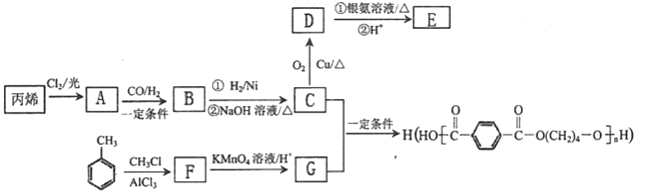
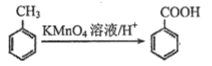
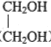 )为某原料制备聚酯纤维
)为某原料制备聚酯纤维 的合成路线________________(无机试剂任选)。
的合成路线________________(无机试剂任选)。