-
具有下列性质的物质可能属于离子晶体的是
A. 熔点801 ℃,易溶于水 B. 熔点10.31 ℃,液态不导电
C. 熔点112.8 ℃,能溶于CS2 D. 熔点97.81 ℃,固态能导电
难度: 简单查看答案及解析
-
在给定的 4 种溶液中,加入以下各种离子,各离子能在原溶液中大量共存的有
A. 滴加石蕊试液显红色的溶液:Fe2+、NH4+、Cl-、NO3-
B. 能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+ 、S2-、Br-
C. 水电离出来的 c(H+)=10-13mol/L 的溶液:K+、HCO3- 、Br- 、Ba2+
D. pH 为 13 的溶液:CO32-、SO32-、S2O32-、Na+
难度: 中等查看答案及解析
-
下列化学用语只能用来表示一种微粒的是
A.
B.
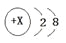 C.CH4O D.C
C.CH4O D.C难度: 简单查看答案及解析
-
有关物质的使用不涉及化学变化的是
A.明矾用作净水剂 B.液氨用作致冷剂
C.漂粉精作消毒剂 D.生石灰作干燥剂
难度: 简单查看答案及解析
-
氢气和氟气反应生成氟化氢的过程中能量变化如图所示。由图可知

A.生成1 molHF气体放出的热量为270 kJ
B.H2(g)+ F2(g)→ 2HF(l)+ 270 kJ
C.反应物的总能量大于生成物的总能量
D.该反应是吸热反应
难度: 简单查看答案及解析
-
做下列实验时,应将温度计水银球插入反应混合液中的是( )
A.制蒸馏水 B.制乙烯 C.制硝基苯 D.石油分馏
难度: 中等查看答案及解析
-
下列物质既含有共价键又含有离子键的是
A.NaOH B.Cl2 C.HCl D.NaCl
难度: 简单查看答案及解析
-
反应2A(g)
2B(g)
E(g)
Q(Q>0),达到平衡时,要使正反应速率降低,A的浓度增大,应采取的措施是
A.缩小体积加压 B.扩大体积减压 C.增加E的浓度 D.降温
难度: 中等查看答案及解析
-
向乙酸、乙醇、乙酸乙酯和水的平衡体系中加入少量含有18O的
,达到新平衡后,体系中含有18O的物质是
A. 乙酸、乙醇 B. 乙醇、乙酸乙酯
C. 乙醇、乙酸乙酯和水 D. 乙酸、乙醇、乙酸乙酯和水
难度: 中等查看答案及解析
-
从海水中提取溴,主要反应为:2Br-+Cl2=Br2+2Cl-,下列说法正确的是
A.溴离子具有氧化性 B.氯气是还原剂
C.该反应属于复分解反应 D.氯气的氧化性比溴单质强
难度: 简单查看答案及解析
-
某有机物结构见图,它不可能具有的性质是( )

A.能跟 KOH 溶液反应 B.能被氧化
C.能发生加聚反应 D.能使溴水褪色
难度: 中等查看答案及解析
-
下列反应可用离子方程式“H+OH=H2O”表示的是
A. H2SO4溶液与Ba(OH)2溶液混合
B. NH3H 2O溶液与HCl 溶液混合
C. NaHCO3溶液与NaOH 溶液混合
D. HNO3溶液与KOH 溶液混合
难度: 简单查看答案及解析
-
能说明二氧化硫具有还原性的事实是
A.使品红溶液褪色 B.使溴水褪色
C.与氢硫酸反应 D.与烧碱反应
难度: 中等查看答案及解析
-
研究电化学的装置如图所示,虚线框中可接a (电流计)或b (直流电源)。下列说法错误的是

A. 接a,该装置将化学能转化为电能
B. 接a,石墨是正极
C. 接b,铁片连正极时被保护
D. 接b,石墨连正极时石墨上产生气泡
难度: 困难查看答案及解析
-
按照有机物的命名规则,下列命名正确的是
A.1,2-二甲基戊烷 B.2-乙基丁烷
C.3-乙基己烷 D.3,4-二甲基戊烷
难度: 中等查看答案及解析
-
海带提碘实验中,不会用到的装置是( )
A.
 B.
B.  C.
C.  D.
D. 
难度: 中等查看答案及解析
-
配制一定物质的量浓度的
溶液时,下列因素会导致溶液浓度偏高的是
A.溶解时有少量液体溅出 B.洗涤液未全部转移到容量瓶中
C.容量瓶使用前未干燥 D.定容时液面未到刻度线
难度: 中等查看答案及解析
-
元素X、Y、Z 位于相同短周期,它们的最高及最低化合价如表所示,下列判断错误的是
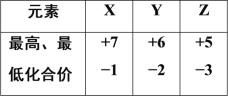
A.原子序数:X>Y>Z
B.原子半径:X>Y>Z
C.稳定性:HX>H2Y>ZH3
D.酸性由强到弱:HXO4>H2YO4>H3ZO4
难度: 中等查看答案及解析
-
下列事实与盐类水解无关的是
A.氯化铝溶液蒸干后灼烧得不到无水氯化铝
B.氯化铁溶液常用作制印刷电路板的腐蚀剂
C.常用热的纯碱溶液除去油污
D.长期施用硫酸铵易使土壤酸化
难度: 中等查看答案及解析
-
测得某pH=2的溶液中有关数据如下:
离子
Na+
Fe3+
?
NO3-
SO42-
浓度(mol/L)
2.0×10-2
1.4×10-2
?
2.0×10-2
2.4×10-2
则该溶液中还可能大量存在的一种离子是
A. Fe2+ B. Al3+ C. Cl- D. CO32-
难度: 中等查看答案及解析
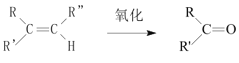 +
+