-
2014年世界环境日中国主题为“向污染宣战”,下列有关环境污染的叙述错误的是( )
A.大气污染主要指CO、SO2、氮氧化物以及粉尘等
B.氮氧化物是造成光化学烟雾的主要原因
C.臭氧可以杀菌消毒,空气中的臭氧含量越高,对人体健康越有利
D.酸雨通常是指pH在5.6以下的降水
难度: 简单查看答案及解析
-
元素周期表和元素周期律对与化学相关的科学技术具有指导作用,人们常在元素周期表中一定的区域内寻找特殊物质,其中寻找催化剂的区域为( )
A.金属与非金属的分界线附近区域 B.过渡元素区域
C.氟、氯、硫、磷等元素附近区域 D.元素周期表左下部分主族元素区域
难度: 简单查看答案及解析
-
下列与OH—具有相同的质子数和电子数的微粒是( )
A.CH4 B.NH4+ C.Cl— D.NH2—
难度: 简单查看答案及解析
-
短周期元素R、T、Q、W、Z在元素周期表中的相对位置如下图所示,五种元素中只有一种金属元素。下列判断错误的是( )
R
T
Q
W
Z
A.W的单质易溶于CS2
B.Q与R可能形成化合物Q3R4
C.T的最高价氧化物的对应水化物为强碱
D.W、Z都有多种含氧酸
难度: 中等查看答案及解析
-
硒被誉为“生命的奇效元素”,富硒食品倍受追捧,重庆多地打造富硒农产品基地。已知硒元素与氧元素同族,与钙元素同周期,下列关于硒的描述错误的是( )
A.原子序数是24
B.元素周期表中硒位于第四周期第VIA族
C.最高价氧化物是SeO3,是酸性氧化物
D.气态氢化物化学式是H2Se,稳定性比HCl差
难度: 中等查看答案及解析
-
下列顺序正确的是( )
A.熔点: SiO2 < NaF<KCl B.水溶性:NH3<SO2<HCl
C.酸性:HF>HCl>HI D.碱性:Mg(OH)2<KOH<RbOH
难度: 中等查看答案及解析
-
下列有关化学键的叙述,正确的是( )
A.分子晶体中一定含有共价键 B.离子晶体中一定含有离子键
C.含有极性键的分子一定是极性分子 D.含有共价键的化合物一定是共价化合物
难度: 简单查看答案及解析
-
下列关于卤素的叙述,错误的是( )
A.单质的颜色随核电荷数的增加逐渐加深
B.单质的氧化性随核电荷数的增加而减弱
C.F2通入NaCl水溶液中反应,生成NaF和Cl2
D.可用硝酸酸化的硝酸银溶液来鉴别Cl—、Br— 、I—离子
难度: 简单查看答案及解析
-
下列过程中没有破坏化学键的是( )
A.氯化氢溶于水 B.氯化铵分解 C.食盐熔化 D.干冰升华
难度: 简单查看答案及解析
-
PH3是一种无色剧毒气体,其分子结构和NH3相似。下列判断错误的是( )
A.PH3分子呈三角锥形
B.PH3分子是极性分子
C.PH3分子中所有原子最外层都满足8e—结构
D.PH3分子稳定性低于NH3分子,因为N-H键键长更短、键能更高
难度: 简单查看答案及解析
-
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( )
A.密度之比为14:15 B.体积相等时具有的电子数相等
C.原子数相等时具有的中子数相等 D.质量相等时具有的质子数相等
难度: 中等查看答案及解析
-
下列有关说法正确的是( )
A.大多数金属在自然界以游离态形式存在
B.工业上,一般用热还原法获得Hg和Ag
C.铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
D.人们常用钢作建造材料而不用纯铁主要原因是钢的机械性能更好
难度: 中等查看答案及解析
-
下列反应既是氧化还原反应又是放热反应的是( )
A.过氧化钠与水反应 B.氨水与稀硫酸的反应
C.灼热的炭与CO2反应 D.Ba(OH)2·8H2O与NH4Cl 的反应
难度: 简单查看答案及解析
-
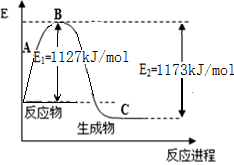
下列关于反应热的叙述,正确的是( )
A.吸热反应一定要高温才能发生
B.1mol酸与碱恰好中和时所放出的热量叫中和热
C.已知C(s,石墨)=C(s,金刚石) △H=+1.9 kJ/mol,则石墨比金刚石稳定
D.已知2H2(g)+O2(g)=2H2O(g) △H= —483.6 kJ/mol,则氢气的燃烧热为241.8 kJ
难度: 简单查看答案及解析
-
一定量的锌与100 mL 18.5 mol/L的浓硫酸充分反应后,锌完全溶解,同时生成气体甲 33.6 L(标准状况)。将反应后的溶液稀释至1 L,测得溶液中c(H+)=0.1 mol/L,则下列叙述中错误的是( )
A.气体甲为SO2和H2的混合物 B.气体甲中SO2与H2的体积之比为4:1
C.反应中共消耗97.5 g Zn D.反应中共转移3 mol电子
难度: 困难查看答案及解析
-
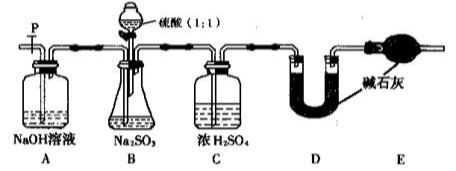
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略了净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是( )
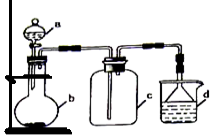
选项
a中的物质
b中的物质
c中收集的气体
d中的物质
A
氯化铵
NaOH
NH3
H2O
B
浓硫酸
Na2SO3
SO2
NaOH溶液
C
稀硝酸
Cu
NO2
H2O
D
浓盐酸
MnO2
Cl2
NaOH溶液
难度: 简单查看答案及解析
-
中学化学中很多“规律”都可以类推,下列根据有关“规律”推出的结论正确的是( )
A.CO2为直线形分子,故CS2也为直线形分子
B.浓硫酸可以干燥HCl气体,故也可用浓硫酸干燥HI气体
C.Na在空气中燃烧会生成Na2O2,故Li在空气中燃烧也会生成Li2O2
D.卤族元素单质随核电荷数增加熔点升高,故碱金属单质熔点也随核电荷数增加而升高
难度: 中等查看答案及解析
-
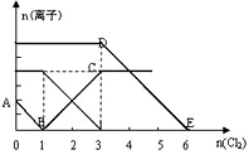
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.a-3=c+2 B.质子数a>b>c>d
C.离子的还原性Y2-<Z- D.离子半径X+< W3+< Y2-< Z-
难度: 中等查看答案及解析
-
(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
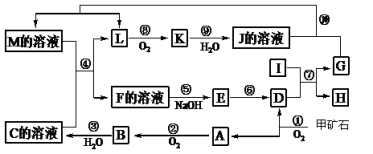
请填写下列空白:
(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为 。反应⑦属于 。
A.吸热反应 B.放热反应 C.置换反应 D.氧化还原反应
(3)反应⑩的离子方程式为 。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。该反应的化学方程式是: 。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为 。
难度: 困难查看答案及解析