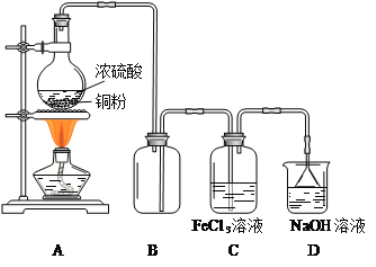
-
2017年9月,英国科学家通过测定地球岩石成分和球粒陨石中25Mg/24Mg比例差异,为月球起源“大撞击”假说提供了重要证据。25Mg与24Mg
A.互为同素异形体 B.具有相似的化学性
C.属于同一种原子 D.具有相同的中子数
难度: 简单查看答案及解析
-
将氯化钠加热至熔融状态后进行电解,可得到金属钠与氯气,此过程中
A.破坏了金属键 B.破坏了共价键
C.形成了离子键 D.形成了共价键
难度: 简单查看答案及解析
-
下列有关二氟二氯甲烷(CF2Cl2)的描述正确的是
A.是非极性分子 B.是正四面体型分子
C.只有一种结构 D.属于烃类化合物
难度: 中等查看答案及解析
-
铝热焊法是一种具有高效率的铁轨快速焊接方法。铝热剂的成分可能是
A.铝粉和铁粉 B.铁粉和氧化铝粉末
C.铝粉和氧化铁粉末 D.氧化铝粉末和氧化铁粉末
难度: 简单查看答案及解析
-
下列化工生产过程所用原料错误的是
A.用乙醇制乙烯 B.用油脂制肥皂
C.用氯气和消石灰制漂粉精 D.用饱和食盐水制烧碱
难度: 简单查看答案及解析
-
下列实验事实能用元素周期律解释的是
A.酸性:H2SO3>H2CO3 B.热稳定性:CH4>SiH4
C.酸性:HCl>H2S D.热稳定性:HNO3>H2CO3
难度: 简单查看答案及解析
-
中科院科学家发现,在常温常压与可见光照射下,N2与H2O在水滑石(LDH)表面发生反应:2N2(g) + 6H2O(g)
4NH3(g) + 3O2(g) – Q(Q>0)。关于该过程的说法错误的是
A.属于固氮过程
B.太阳能转化为化学能
C.反应物的总能量高于生成物的总能量
D.反应物的总键能高于生成物的总键能
难度: 简单查看答案及解析
-
下列事实不能用勒沙特列原理解释的是
A.新制氯水在光照下颜色变浅
B.工业合成氯化氢时氢气过量
C.棕红色NO2加压后颜色先变深后变浅
D.向饱和NaCl溶液中通入HCl,有晶体析出
难度: 简单查看答案及解析
-
若乙酸分子中的氧都是16O,乙醇分子中的氧都是18O,将两者等物质的量混合进行催化反应,一段时间后,体系中含有18O的物质是(催化剂中不含氧)
A.只有乙酸乙酯 B.水和乙醇
C.乙酸乙酯和乙醇 D.乙酸乙酯、乙醇、乙酸和水
难度: 简单查看答案及解析
-
提纯下列物质所选试剂及对应分离方法均可行的是
物质
杂质
试剂
方法
A
乙烷
乙烯
酸性高锰酸钾溶液
洗气
B
乙酸乙酯
乙酸
氢氧化钠溶液
洗涤分液
C
溴苯
溴
碘化钾溶液
萃取分液
D
乙醇
水
生石灰
蒸馏
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
1 mol 苯乙烯(
)在不同条件下与H2发生加成反应时,产物存在差异:
条件
消耗氢气
加成产物
①
室温、低压、催化剂
1 mol
②
高温、高压、催化剂
4 mol
下列说法正确的是
A.两种条件下的加成产物都属于芳香烃
B.两种条件下的加成产物都能使酸性高锰酸钾溶液褪色
C.两种条件下的加成产物都能在光照条件下与溴进行取代
D.该现象说明侧链上的碳碳双键比苯环内的碳碳双键更活泼
难度: 简单查看答案及解析
-
为探究铁与稀硫酸的反应速率,向反应混合液中加入某些物质,下列关于v(H2)变化判断正确的是
A.加入Na2SO4 溶液,v(H2)减小
B.加入 NaHSO4固体,v(H2)不变
C.加入 NaNO3 固体,v(H2)不变
D.加入 CuSO4固体,v(H2)减小
难度: 中等查看答案及解析
-
某无色透明溶液放入铝片后会有氢气产生。向原溶液中加入下列物质,一定不能大量存在的是
A.NH4Cl B.Al(OH)3 C.Cu(NO3)2 D.CaCO3
难度: 简单查看答案及解析
-
将一定质量Na置于氧气中缓缓加热直至完全氧化,生成0.1 mol Na2O和 0.05 mol Na2O2,将该混合物溶于足量水,最终得到pH = 12的NaOH溶液。关于此过程说法正确的是(NA表示阿伏加德罗常数的值)
A.钠与氧气反应过程中共转移0.3 NA个电子
B.钠与氧气反应过程中消耗氧气体积为 2.24 L
C.混合物中含有0.2 NA个阴离子
D.最终得到NaOH溶液中含有0.01 NA个OH—
难度: 中等查看答案及解析
-
离子方程式Ba2+ + OH— + H+ + SO42— → BaSO4↓ + H2O可以表示Ba(OH)2溶液与
A.少量稀硫酸的反应 B.足量稀硫酸的反应
C.少量NaHSO4溶液的反应 D.足量NH4HSO4溶液的反应
难度: 中等查看答案及解析
-
某反应的氧化剂与还原剂及部分产物如下所示:2Mn2+ + 5IO4— + …… → 2MnO4— + ……已知该反应体系还包括H+、H2O与另一种含碘微粒。对于该氧化还原反应说法正确的是
A.Mn2+是氧化剂,IO4—是还原剂
B.体系中另一种含碘微粒为I—
C.随着反应进行,溶液pH不断上升
D.每有1 mol IO4—参加反应,转移2 mol电子
难度: 中等查看答案及解析
-
常温下,向
的
溶液中逐滴滴加
的
溶液。溶液
随滴入
溶液体积变化如图所示。下列说法正确的是( )

A.
点的
B.
点时,
C.
点时,
D.从a→d,水的电离度先增大后减小
难度: 中等查看答案及解析
-
化学式为C3H4O2的液态有机物X(不含环状结构)不能与碳酸氢钠发生反应,推测X不可能发生的反应是
A.消去反应 B.酯化反应 C.加聚反应 D.银镜反应
难度: 简单查看答案及解析
-
铁片和金属N可构成如图所示装置。下列说法正确的是

A.金属活动性:Fe>N
B.金属N发生了氧化反应
C.该装置模拟的是铁的析氢腐蚀
D.该装置模拟的外加电流的阴极保护法
难度: 简单查看答案及解析
-
取某固体样品进行如下实验:

根据实验现象,该固体样品的成分可能是
A.Na2CO3、AgNO3、KNO3 B.K2SO4、Ba(OH)2、Na2CO3
C.K2CO3、NaCl、Ba(NO3)2 D.K2SO4、MgCl2、NaOH
难度: 中等查看答案及解析
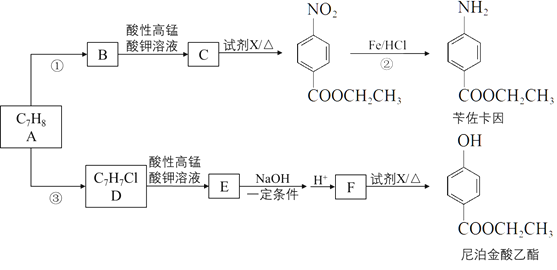
 )
)