-
化学与生活、人类生产、社会可持续发展密切相关,下列有关说法正确的是( )
A. “辽宁舰”上用于舰载机降落拦阻索的是一种特种钢缆,属于新型无机非金属材料
B. 石油裂化和裂解制取乙烯、丙烯等化工原料不涉及化学变化
C. “霾尘积聚难见路人”,雾霾所形成的气溶胶没有丁达尔效应
D. 电热水器用镁棒防止金属内胆腐蚀,原理是牺牲阳极的阴极保护法
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 2.8g乙烯和丙烯的混合气体中共用电子对数目为0.4NA
B. 1L1mol·L-1的稀硝酸中,含氧原子数为3NA
C. 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA
D. 1mL 0.1mol/L FeCl3溶液滴入沸水中可生成含有1.0×10-4NA个Fe(OH)3胶粒的胶体
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是( )
A. 0.1 mol·L-1 FeSO4溶液:Na+、K+、Cl-、NO3-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 加入铁粉放出氢气的溶液:NH4+、Fe3+、ClO-、SO42-
D. 水电离的c(H+)=1×10-13mol·L-1的溶液:K+、Mg2+、SO42-、F-
难度: 中等查看答案及解析
-
将15.66g镁铝合金加入到800mL稀硝酸中,恰好完全反应(假设反应中还原产物只有NO),向所得溶液中加入足量的3mol·L-1NaOH溶液,测得生成沉淀的质量与原合金的质量相等,则下列有关叙述不正确的是
A. 原稀硝酸的浓度为2.6mol·L-1 B. 生成NO的体积为11.648L(标准状况)
C. 反应过程中共消耗1.56molNaOH D. 合金中Al的质量分数约为58.6%
难度: 困难查看答案及解析
-
已知部分弱酸的电离平衡常数如表所示
弱酸
CH3COOH
HClO
H2CO3
H2SO3
电离平衡常数Ka(25℃)
1.75×10-5
2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是( )
A. CO2+H2O +2C1O- =CO32-+2HClO
B. 2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O
C. SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO
D. SO2+CO32-=CO2+SO32-
难度: 中等查看答案及解析
-
钠-CO2电池的工作原理如图所示,吸收的CO2转化为Na2CO3固体和碳,沉积在多壁碳纳米管(MWCNT)电极表面,下列说法不正确的是( )
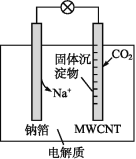
A.负极反应式为Na-e-=Na+
B.多壁碳纳米管(MWCNT)作电池的正极
C.可以用乙醇代替四甘醇二甲醚作有机溶剂
D.电池总反应式为4Na+3CO2=2Na2CO3+C
难度: 中等查看答案及解析
-
25℃时,用0.0500 mol·L-1H2C2O4溶液滴定 25.00 mL0.l000mol·L-1NaOH溶液所得滴定曲线如图。下列说法正确的是()
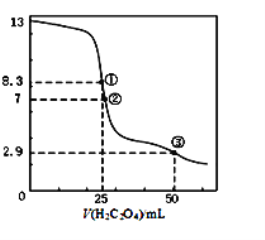
A.点①所示溶液中:c(H+)+c(H2C2O4)+c(HC2O4-)=c(OH-)
B.点②所示溶液中:c(HC2O4-)+c(C2O42-)=c(Na+)
C.点③所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D.滴定过程中可能出现:c(Na+)>c(C2O42-)=c(HC2O4-)>c(H+)>c(OH-)
难度: 中等查看答案及解析