-
垃圾分类回收,有利于节约资源、保护环境。下列可回收垃圾中其材质为金属的是
A.废报刊 B.碎玻璃 C.易拉罐 D.塑料瓶
难度: 简单查看答案及解析
-
下列常见物质的俗名与化学式对应正确的是
A.明矾——CuSO4·5H2O B.小苏打——NaHCO3
C.熟石灰——CaCl2 D.大理石——BaCO3
难度: 简单查看答案及解析
-
在标准状况下氧气气体摩尔体积约为
A.22.4 L B.32 g·mol-1 C.22.4 L·mol-1 D.32 mol·L-1
难度: 简单查看答案及解析
-
下列过程只涉及物理变化的是
A.干冰升华 B.酿酒成醋 C.高炉炼铁 D.伐薪烧炭
难度: 简单查看答案及解析
-
Ca可用于研究中药的钙拮抗作用及机理,这里的“45”是指该原子的
A.质子数 B.中子数 C.质量数 D.电子数
难度: 简单查看答案及解析
-
下列物质属于离子化合物的是
A.H2SO4 B.NH3 C.CO2 D.KOH
难度: 简单查看答案及解析
-
下列各组物质互为同素异形体的是
A.35Cl和37Cl B.CH3CH2OH和CH3OCH3
C.O2和O3 D.CH3CH2OH和CH3COOH
难度: 简单查看答案及解析
-
下列气体可用如图所示方法收集的是
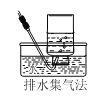
A.NO2 B.CH4 C.SO2 D.NH3
难度: 简单查看答案及解析
-
下列关于Cl2性质的说法正确的是
A.是无色无味的气体 B.能使干燥的有色布条褪色
C.与石灰乳反应可制取漂白粉 D.与铁粉共热生成氯化亚铁
难度: 简单查看答案及解析
-
下列说法正确的是
A.Na2O可用作供氧剂 B.电解氯化钠溶液制取金属钠
C.Fe2O3可用于制作红色涂料 D.铝槽车可用于贮存运输稀硝酸
难度: 简单查看答案及解析
-
下列化学用语表示正确的是
A.苯的结构简式:C6H6 B.N2的电子式:
C.Al3+的结构示意图:
D.氯化钙的电离方程式:CaCl2===Ca2++Cl22-
难度: 简单查看答案及解析
-
下列反应能量变化与图一致的是
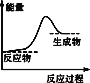
A.CaCO3高温分解 B.Na与H2O的反应
C.NaOH与HCl反应 D.Al与Fe2O3的铝热反应
难度: 简单查看答案及解析
-
在含有大量的Ba2+、OH-、NO3-的溶液中,还可能大量共存的离子是( )
A. CO32- B. Cl- C. H+ D. Fe2+
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是
A.铁钉与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑
B.Cu(OH)2与 H2SO4溶液的反应:OH-+H+=H2O
C.铝与烧碱溶液反应:Al+2H2O+2OH-=AlO2-+2H2↑
D.MgCl2溶液与氨水反应:Mg2++2NH3·H2O = Mg(OH)2↓+2NH4+
难度: 简单查看答案及解析
-
图为氢氧燃料电池示意图。下列说法正确的是
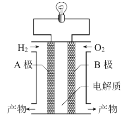
A.A极是正极
B.B极发生还原反应
C.该装置能将电能转化成化学能
D.电子由B极通过导线流向A极
难度: 简单查看答案及解析
-
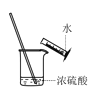
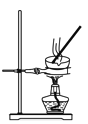
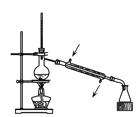
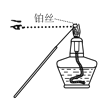
下列图示装置能达到实验目的或操作正确的是
A.稀释浓硫酸
B.蒸发结晶
C.制少量蒸馏水
D.检验钾元素
难度: 简单查看答案及解析
-
关于Fe(OH)3胶体下列说法不正确的是
A.粒子直径大于NaCl溶液中溶质粒子 B.能吸附水中的悬浮物
C.属于纯净物 D.能产生丁达尔效应
难度: 简单查看答案及解析
-
下列关于各有机物的说法不正确的是
A.甲烷属于烃类 B.苯分子中的所有原子在同一平面内
C.乙醇可与NaOH溶液反应 D.乙酸可与NaHCO3溶液反应生成CO2
难度: 简单查看答案及解析
-
下列有机反应属于取代反应的是
A.CH2=CH2+H2O
CH3CH2OH
B.nCH2=CH2
C.2CH3CH2OH+O2
2CH3CHO+2H2O
D.CH3COOH+CH3CH2OH
CH3COOCH2CH3+H2O
难度: 简单查看答案及解析
-
下列实验方案不能达到目的的是
A.用浓硫酸除去NH3中的水蒸汽
B.用灼热的CuO除去CO2中混有的少量CO
C.用加热法除去Na2CO3固体中的少量NaHCO3
D.用饱和NaCl溶液除去Cl2中的少量HCl杂质
难度: 简单查看答案及解析
-
X、Y、Z、W属于1~20号元素且原子序数依次增大。X与Z同主族,Y与W同主族。X原子的最外层电子数是其内层电子数的3倍,Y在同周期主族元素中原子半径最大。下列说法正确的是
A.金属性:Y>W B.原子半径:r(X)>r(Y)>r(Z)
C.简单气态氢化物的热稳定性:Z>X D.由X和Y组成的化合物为离子化合物
难度: 简单查看答案及解析
-
硫酸亚铁铵晶体的化学式可表示为(NH4)xFey(SO4)z· nH2O。用FeSO4溶液与(NH4)2SO4饱和溶液混合可析出硫酸亚铁铵晶体,过滤后取滤液分别进行下列实验:⑴向滤液中,滴加氯水,再滴入KSCN溶液,溶液变红;⑵向滤液中滴加MgCl2溶液,无白色沉淀生成;⑶向滤液中滴加NaOH溶液,加热,生成的气体能使湿润的红色石蕊试纸变蓝。下列说法正确的是
A.化学式中x=y=z B.滤液中含Fe2+
C.滤液中不含SO42- D.滤液中含NH4+
难度: 中等查看答案及解析