-
下列关于能量变化的说法正确的是 ( )
A.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
B.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
C.已知C(石墨,s)===C(金刚石,s ) ΔH>0,则金刚石比石墨稳定
D.化学反应遵循质量守恒的同时,也遵循能量守恒
难度: 中等查看答案及解析
-
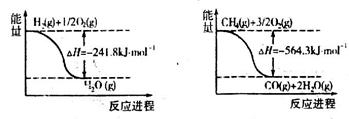
1g H2完全燃烧生成液态水放出142.9KJ热量,下列反应的热化学方程式正确的是( )
A.H2 + O2 = 2H2O△H= -571.6KJ/mol
B.H2(g)+ 1/2O2(g)= H2O (l)△H= -142.9KJ/mol
C.H2(g)+ 1/2O2(g)= H2O (l)△H= -285.8KJ/mol
D.2H2(g)+ O2(g) = 2H2O (g)△H=" -571.6KJ/mol"
难度: 中等查看答案及解析
-
下列关于热化学反应的描述中正确的是 ( )
A.需要加热才能发生的反应一定是吸热反应
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) = 2CO(g)+O2(g)反应的△H=2×283.0kJ/mol
C.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
D.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反映的中和热△H=2×(-57.3)kJ/mol
难度: 中等查看答案及解析
-
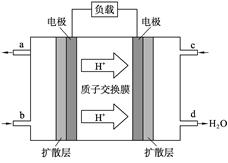
铜锌原电池工作时,下列叙述正确的是( )

A、正极反应为:Zn—2e-=Zn2+
B、B、在外电路中,电子从铜片流向锌片
C、电池反应为:Zn+Cu2+=Zn2+ +Cu
D、盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
如下图两个电解槽中,A、B、C、D均为石墨电极。若电解过程中共有0.02mol电子通过,下列叙述中正确的是( )
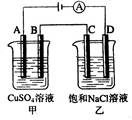
A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式4OH--4e-= 2H2O+O2↑
C.烧杯中C极上电极反应式为4H+ + 4e-=2H2↑
D.乙烧杯中滴入酚酞试液,D极附近先变红
难度: 困难查看答案及解析
-
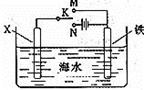
某兴趣小组为研究电化学原理,设计如右图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动
难度: 中等查看答案及解析
-
2A(g)+B(g)
3C(g)+4D(g)的反应,在不同条件下的反应的速率最快的是( )
A.v (A) = 0.7mol·L-1·min-1 B.v (B) = 0.3mol·L-1·min-1
C.v (C) = 0.9mol·L-1·min-1 D.v (D) = 1.1mol·L-1·min-1
难度: 中等查看答案及解析
-
对可逆反应A2(g)+B2(g)
2AB(g) 在一定条件下,达到平衡状态的标志是( )
A.单位时间内,生成n mol A2的同时,生成n mol的B2
B.单位时间内生成2n mol AB的同时,生成n mol的B2
C.平衡时容器内的总压强不随时间而变化
D.平衡时容器内各物质的物质的量比为1∶1∶2
难度: 中等查看答案及解析
-
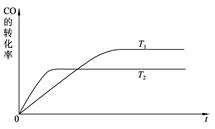
在恒容密闭容器中存在下列平衡:
。
的平衡物质的量浓度
与温度T的关系如右图所示。下列说法错误的是( )
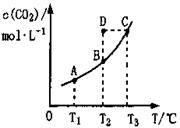
A.反应
的
B.在
时,若反应处于状态
,则一定有
C.平衡状态
与
相比,平衡状态
的
小
D.若
时的平衡常数分别为
,则
难度: 困难查看答案及解析
-
一定条件下,体积为10 L的密闭容器中,1 mol X和1 mol Y进行反应:2X(g)+Y(g)
Z(g),经60 s达到平衡,生成0.3 mol Z。下列说法正确的是( )
A.以X的反应速率为0.001 mol·L-1·s-1
B.将容器体积变为20 L,Z的平衡浓度变为原来的1/2
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的ΔH>0
难度: 困难查看答案及解析
-
在恒容条件下化学反应: 2SO2 ( g ) + O2 ( g )
2SO3( g ) ; △ H =—QkJ·mol-1
在上述条件下分别充入的气体和反应放出的热量 ( Q )如下表所列:
容器
SO2 (mol)
O2(mol)
N2(mol)
Q(kJ·mol-1)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以上数据,下列叙述正确的是( )
A.在上述条件下反应生成 lmolSO3固体放热 Q/2 kJ
B.Q= Q1 <2Q2<2Q3
C.Ql ="2" Q2= 2Q3 = Q
D.2Q2 = 2Q3 < Q1 < Q
难度: 中等查看答案及解析
-
常温下,某溶液中由水电离出来的c(H+)=1.0×10-13mol·L-1,该溶液可能是( )
①二氧化硫 ②氯化铵水溶液 ③硝酸钠水溶液 ④氢氧化钠水溶液
A.①④ B.①② C.②③ D.③④
难度: 中等查看答案及解析
-
已知乙酸(HA)的酸性比甲酸(HB)弱,在物质的量浓度均为0.1mol/L的NaA
和NaB混合溶液中,下列排序正确的是( )
A.c(
)>c(A-)>c(B-)>c(H+) B.c(OH—)>c(HA)>c(HB)>c(H+)
C.c(
)>c(B-)>c(A-)>c(H+) D. c(
)>c(HB)>c(HA)>c(H+)
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
B.将等体积pH=4的盐酸和醋酸稀释成pH=5的溶液,醋酸所需加入的水量多
C.向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
D.0.2 mol·L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
已知:Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16 ,Ksp(Ag2CrO4)=2.0×10-12,则下列难溶盐的饱和溶液中,Ag+浓度大小顺序正确的是( )
A.AgCl>AgI> Ag2CrO4 B.Ag2CrO4>AgCl>AgI
C.AgCl> Ag2CrO4>AgI D.Ag2CrO4>AgI>AgCl
难度: 中等查看答案及解析
-
为证明某可溶性一元酸(HX)是弱酸,有如下实验方案,其中不合理的是( )
A.室温下,测0.1 mol/L HX溶液的pH,若pH>1,证明HX是弱酸
B.室温下,测1 mol/L NaX溶液的pH,若pH>7,证明HX是弱酸
C.将等浓度、等体积的HCl和NaX溶液混合,若混合溶液pH<7,证明HX是弱酸
D.相同条件下,对0.1 mol/L的HCl和0.1 mol/L的HX进行导电性实验,若与HX溶液相
串联的灯泡较暗,证明HX为弱酸
难度: 简单查看答案及解析
-
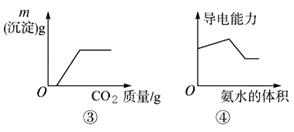
下列图像表达正确的是 ( )
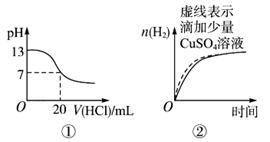
A.图①表示25 ℃时,用0.1 mol/L盐酸滴定20 mL 0.1mol/L氨水
B.图②表示常温下,等量锌粉分别与两份足量的等体积等浓度的盐酸反应
C.图③表示向CaCl2溶液中通入CO2
D.图④表示向醋酸溶液中滴入氨水
难度: 简单查看答案及解析