-
已知:苯酚是一种无色晶体,有毒,对皮肤、粘膜有强烈的腐蚀作用,久置于空气中被氧化而呈现粉红色。下列危险化学品标志可用于苯酚的是( )
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
下列操作或装置能达到实验目的的是
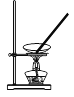
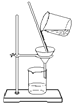
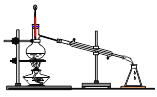
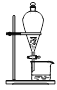
A.灼烧 B.分离Fe(OH)3胶体 C.制备蒸馏水 D.分离酒精和水
难度: 简单查看答案及解析
-
下列有关实验操作的叙述错误的是( )
A.过滤操作中,漏斗的尖端应接触烧杯内壁
B.分液时,下层溶液从下口放出后,上层溶液继续从下口放出
C.蒸馏时,加入液体的体积不超过圆底烧瓶容积的三分之二
D.向容量瓶转移液体时,导流用的玻璃棒可以接触容量瓶内壁
难度: 简单查看答案及解析
-
下列物质的分类组合不正确的是( )
①混合物:空气、矿泉水、水银、盐酸
②酸性氧化物:CO、CO2、SO2、SO3
③酸:H2SO4、H2S、CH3COOH、NaHS04
④碱:生石灰、NH3·H2O、Cu(OH)2CO3
⑤盐:NaHCO3、纯碱、AlCl3
⑥电解质:HCl、CaCO3、NH3
A.①④ B.①②④⑥ C.①②③④⑥ D.全部
难度: 中等查看答案及解析
-
下列有关胶体的叙述正确的是( )
A.胶体与溶液的本质区别是胶体能发生丁达尔效应
B.向胶体中加入蔗糖溶液,产生聚沉现象
C.静电除尘利用了胶体带电的性质
D.向沸水中滴加饱和氯化铁溶液制备Fe(OH)3胶体
难度: 中等查看答案及解析
-
实验中需1mol/L的CuSO4溶液950mL,配制时应选用的容量瓶的规格和称取的胆矾的质量分别是:( )
A. 950mL,152g B. 950mL, 237.5g
C. 1000mL,160g D. 1000mL,250g
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.在氧化还原反应中,肯定有一种元素被氧化,另一种元素被还原
B.有单质参加或生成的反应一定属于氧化还原反应
C.失电子难的原子,获得电子的能力一定强
D.元素由化合态变成游离态时,它可能被氧化,也可能被还原
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数,下列叙述正确的是( )
①标准状况下,NA个分子所占的体积约是22.4L
②常温常压下,28gC0与N2的混合气体中分子数为NA
③19.6gH2SO4与0.2NA个H3PO4含有相同的氧原子数
④1L1mol/L的醋酸溶液中含有NA个CH3COO-
⑤NA个HC1分子溶于1L水中,所得溶液的浓度为1mol/L
⑥1molOH- 中含有9NA个电子
A.①③④⑤⑥ B.②③④ C.②③ D.③④⑤
难度: 简单查看答案及解析
-
在同温同压下,A容器的H2和B容器的NH3,若所含氢原子数目之比为2:3,则这两个容器的体积比是
A.1:1 B.2:3 C.3:2 D.1:3
难度: 中等查看答案及解析
-
向等物质的量浓度的NaC1、MgCl2、AlC13三种溶液中,加入足量的AgNO3溶液,产生的沉淀的质量比为3:2:1,则NaC1、MgCl2、AlC13三种溶液体积比为( )
A.9:3:1 B.6:3:2 C.3:2:1 D.1:1:1
难度: 中等查看答案及解析
-
下列变化必须加入氧化剂才能实现的是( )
A.KMnO4→O2 B.HCl→Cl2 C.CaCO3→CO2 D.Fe3+→Fe2+
难度: 简单查看答案及解析
-
C1元素最低价态为-1价,最高价态为+7价,根据下列化合物中的C1元素判断,下列说法正确的是( )
A.NaC1具有氧化性 B.KClO3只具有氧化性
C.NaClO既具有氧化性,也具有还原性 D.HClO4具有还原性
难度: 中等查看答案及解析
-
下列状态的物质,既能导电又属于电解质的是( )
A.NaC1固体 B.液态H2SO4 C.葡萄糖 D.熔融的NaOH
难度: 中等查看答案及解析
-
根据反应(1)→(4),可以判断下列4个物质的氧化性由强到弱的正确顺序是
⑴Cl2+2KI=2KCl+I2;⑵2FeCl2+Cl2=2FeCl3;
⑶2FeCl3+2HI=2FeCl2+2HCl+I2;⑷H2S+I2=S+2HI;
A.S>I2>Fe3+>Cl2
B.Cl2>Fe3+>I2>S
C.Fe3+>Cl2>S>I2
D.Cl2>I2>Fe3+>S
难度: 中等查看答案及解析
-
在标准状况下,下列物质所占体积最大的是(NA表示阿伏加德罗常数)( )
A.18gH2O B.NA个氮气分子 C.44.8L HCL D.含有5NA个氢原子的H2
难度: 中等查看答案及解析
-
下列有关容量瓶和分液漏斗的使用,正确的是( )

A.使用容量瓶前必须对其进行干燥
B.把混合液体转移至分液漏斗,塞上玻璃塞,如图所示用力振荡
C.经几次振荡并放气后,手持分液漏斗静置待液体分层
D.定容后,盖好瓶塞,用食指顶住瓶塞,用另一只手托住瓶底,把容量瓶倒转和摇动多次
难度: 中等查看答案及解析
-
下列化学方程式中,标明电子转移方向和数目均正确的是( )
A.
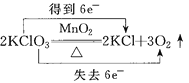
B.
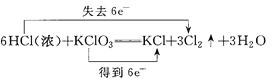
C.

D.
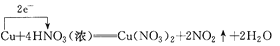
难度: 中等查看答案及解析
-
关于粗盐提纯,下列说法正确的是( )
A.溶解粗盐时,应尽量使溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩有少量液体时,停止加热利用余热将液体蒸干
D.粗盐经溶解、过滤、蒸发后,制得的精盐为纯净的氯化钠
难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向FeCl2溶液中通入Cl2:Fe2+Cl2═Fe3++2C1-
B.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2
C.向小苏打溶液中滴加盐酸;CO32-+2H+═H2O+CO2
D.向NH4Cl溶液中滴入烧碱溶液并加热:NH4++OH-
NH3↑+H2O
难度: 中等查看答案及解析
-
下列各组中的离子在强酸或强碱溶液中均能大量共存且溶液无色的是( )
A.H+、Na+、MnO4-、SO42- B.Na+、CO32-、A13+、C1
C.K+、Na+、Cl、SO42- D.K+、C1、Ba2+、HCO3-
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是( )
选项
实验目的
实验操作
A
称取2.0g NaOH固体
先在托盘上各放一张滤纸然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
检验溶液中是否含SO42-
加入稀盐酸酸化的BaCl₂溶液,出现白色沉淀,则溶液中含有SO42-
C
鉴别溴水和碘水
分别取少量溶液于两支试管中,加入CCl4,振荡,静置,观察下层溶液的颜色
D
配制浓度为0.10 mol.L-1的MgCl2溶液
称取MgCl2固体0.95g,放入100mL容量瓶中,加水溶解并稀释至刻度
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将30 mL 0.5 mol·L-1 NaOH溶液加水稀释到500 mL,关于稀释后的溶液叙述不正确的是( )
A.浓度为0.03 mol·L-1 B.从中取出10 mL溶液,其浓度为0.03 mol·L-1
C.含NaOH 0.6 g D.从中取出10 mL溶液,含NaOH 0.015 mol
难度: 中等查看答案及解析
-
被称为“万能还原剂”的NaBH4溶于水并和水反应:NaBH4+2H2O2═2NaBO2+4H2,下列说法正确的是(NaBH4中H为-1价)( )
A.NaBH4既是氧化剂又是还原剂 B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原 D.被氧化的元素与被还原的元素质量之比为1:1
难度: 中等查看答案及解析
-
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO = 2NaCl+NaClO3。在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO B.NaCl、NaClO3 C.NaClO、NaClO3 D.NaClO3、NaClO4
难度: 中等查看答案及解析
-
24mL 0.05mol/L 的Na2SO3溶液恰好与20mL 0.02mol/L的K2Cr2O7溶液完全反应;已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为
A.+2 B.+3 C.+4 D.+5
难度: 简单查看答案及解析
