-
下列有关说法正确的是( )
A.赏心悦目的雕花玻璃是用氢氟酸对玻璃刻蚀制成的
B.正常雨水的pH为7
C.煤、石油、沼气是当今世界最重要的三种化石燃料
D.生物质能的缺点是严重污染环境
难度: 简单查看答案及解析
-
分类是重要的科学研究方法,下列物质分类错误的是( )
A.单质:液溴、白磷、臭氧 B.酸性氧化物:SO3、CO2、NO
C.混合物:铝热剂、漂粉精、水玻璃 D.同素异形体:C60、石墨、金刚石
难度: 中等查看答案及解析
-
下列说法一定错误的是( )
A.某些花岗石产生氡(
Rn),从而对人体产生伤害,Rn元素的相对原子质量是222
B.Se是人体必需的微量元素,
Se和
Se互为同位素,是两种不同的核素
C.
U的浓缩一直被国际社会关注,其中子数和质子数之差为51
D.112号元素属于过渡元素
难度: 简单查看答案及解析
-
下列反应中,生成物所贮的化学能比反应物所贮化学能要多的是( )
A.CaO+H2O=Ca(OH)2
B.NaOH+HCl=NaCl+H2O
C.CH4+2O2
CO2+2H2O
D.CO2+C
2CO
难度: 简单查看答案及解析
-
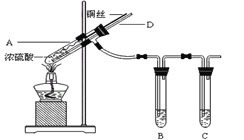
利用下列实验装置能完成相应实验的是( )
A.制取并收集氯化氢
 B.稀释浓硫酸
B.稀释浓硫酸 C.除去氯气中的氯化氢
C.除去氯气中的氯化氢 D.分离液体混合物
D.分离液体混合物
难度: 中等查看答案及解析
-
下列各组离子在指定条件下,能大量共存的是( )
A.碱性溶液中:Rb+、Cs+、CH3COO-、Br-
B.饱和溴水中 I-、NO3-、Na+、SO32-
C.D+、Cl―、NO3―、SiO32-
D.Ag+、Fe3+、Br―、SO42―
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.碳酸钠溶液中滴加等物质的量的乙酸:CO32-+ 2CH3COOH ═ CO2↑ + H2O + 2CH3COO-
B.用氨水吸收少量的二氧化硫:2NH3•H2O + SO2 ═ 2NH4+ + SO32- + H2O
C.NaHSO4溶液中加Ba(OH)2溶液至中性:Ba2+ + OH- + H+ +SO42— ═ BaSO4↓ + H2O
D.大苏打溶液中加入过量的酸性高锰酸钾:3S2O32— + 4MnO4-+ 6H+ ═ 4Mn2+ + 6SO42— + 3H2O
难度: 中等查看答案及解析
-
下列叙述正确的是(用NA代表阿伏加德罗常数的值)( )
A.2.4 g 金属镁变为镁离子时失去的电子数为0.1NA
B.在酸性甲烷燃料电池中,每消耗8.0g CH4,电路中转移的电子总数为5NA
C.在标准状况下,22.4 L CH4与NH3混合气所含有的质子总数为10NA
D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA
难度: 中等查看答案及解析
-
Q、X、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外层电子数之和为22。下列说法正确的是
A.Y的原子半径比X的大
B.Q的最高价氧化物的水化物的酸性比Z的强
C.X、Y和氢3种元素形成的化合物中都只有共价键
D.Q的单质具有半导体的性质,Q与Z可形成化合物QZ4
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如下表:
元素代号
X
Y
Z
M
R
Q
原子半径(×10-10 m)
1.86
0.99
1.43
1.60
0.75
0.74
主要化合价
最高正价
+1
+7
+3
+2
+5
--
最低负价
--
-1
--
--
-3
-2
下列说法正确的是
A.离子半径r(R3-)﹥r(X+)﹥r(Z3+) B.元素X和Q形成的化合物中不可能含有共价键
C.Q2-比R3-更容易失去电子 D.Y的含氧酸的酸性一定比R的含氧酸的酸性强
难度: 困难查看答案及解析
-
下列有关物质说法正确的是( )
A.加热NH4Cl只破坏离子键
B.4.48L氨气中含有0.6NA个N-H键
C.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构
D.某元素最高价氧化物的水化物和氢化物的化学式分别为H2XO4 、H2X
难度: 简单查看答案及解析
-
有关电化学知识的描述正确的是( )
A.充电电池又称二次电池,它在放电时所进行的氧化还原反应,在充电时可以逆向进行,使电池恢复到放电前的状态
B.CaO+H2O===Ca(OH)2,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
C.电池的两极一定是由活泼性不同的两种电极组成
D.原电池工作时,正极表面一定有气泡产生
难度: 简单查看答案及解析
-
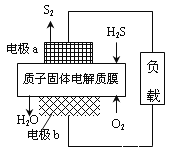
如图是NO2和O2形成的原电池装置。下列说法不正确的是

A.石墨Ⅱ做正极,O2发生还原反应
B.该电池放电时NO3-从右侧向左侧迁移
C.当消耗1mol NO2时,电解质中转移1mol e
D.石墨Ⅰ附近发生的反应为NO2+NO3--e-=N2O5
难度: 简单查看答案及解析
-
我国拟大力推广使用氢氧燃料电池的公共汽车。某种以质量分数为30%的KOH溶液为电解质的氢氧燃料电池在使用时的电极反应如下:2H2 +4OH- - 4e-
4H2O, O2 + 2H2O + 4e-
4OH- ,下列有关该氢氧燃料电池的说法中,不正确的是( )
A.该电池工作一段时间后,KOH溶液的浓度逐渐降低
B.供电时的总反应为:2H2 + O2
2H2O
C.燃料电池的能源利用率较高,且清洁环保,持续性好
D.该燃料电池可以用两个活性相同的电极
难度: 中等查看答案及解析
-
下列关于化学反应的描述中正确的是( )
A.当一个化学反应在一定条件下达到最大限度时,反应速率也最大
B.用锌片和足量的稀硫酸反应制氢气时,加入少量氧化铜,可以加快反应的速率且生成氢气的总量不变
C.燃烧一定是放热反应,也是氧化还原反应
D.化学反应中能量变化的大小与反应物的状态无关
难度: 简单查看答案及解析
-
反应A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率如下,其中表示反应速率最快的是
A.v(A)=0.15 mol·L-1·min-1
B.v(B)=0.015 mol·L-1·s-1
C.v(C)=0.40 mol·L-1·min-1
D.v(D)=0.45 mol·L-1·min-1
难度: 简单查看答案及解析
-
已知白磷和P4O6的分子结构如图,现提供以下化学键的键能:P-P:198kJ·mol-1、P-O:360kJ·mol-1、O=O:498kJ·mol-1,则反应P4(白磷)+3O2=P4O6的反应热△H为( )

A.-126kJ·mol-1
B.-1638kJ·mol-1
C.+126kJ·mol-1
D.+1638kJ·mol-1
难度: 中等查看答案及解析
-
当10mL浓度为1mol/L的盐酸与足量锌粉反应时,若加入适量的下列物质,能减慢反应速率又不影响氢气生成的是( )
①K2SO4溶液 ②CH3COONa固体 ③CuSO4溶液 ④Na2CO3固体 ⑤Na2SO4固体 ⑥水
A.①③⑤ B.②③④ C.④⑤⑥ D.①②⑥
难度: 中等查看答案及解析
-
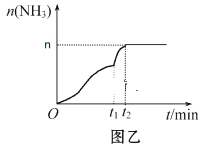
在一定温度下,在某密闭容器内某一反应中M、N的物质的量随反应时间变化的曲线如图所示.下列叙述中,正确的是( )

A.该反应的化学方程式为M═2N
B.若t1=1,则反应开始至t1时间段M 的反应速率为1mol﹒L-1﹒min-1
C.t3时正反应速率等于逆反应速率
D.t2时正逆反应速率相等,反应达到平衡状态
难度: 简单查看答案及解析
-
在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(s)
2B(g)+C(g)+D(g)已达到平衡状态的是( )
①混合气体的压强②混合气体的密度③A的物质的量浓度④混合气体总物质的量 ⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值 ⑦混合气体总质量 ⑧混合气体总体积
A.③④⑤⑥⑧ B.①②⑥⑦ C.①②④⑦ D.①③⑤⑧
难度: 中等查看答案及解析