-
朱自清在《荷塘月色》冲写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的班驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 空气中的小水滴颗粒直径大小约为1nm--100nm
B. 空气中的小水滴颗粒的布朗运动
C. 雾是一种胶体,胶粒带相同电荷
D. 发生丁达尔效应
难度: 简单查看答案及解析
-
已知常温下在溶液中可发生如下两个离子反应:Ce4++Fe2+=Fe3++Ce3+,Sn2++2Fe3+=2Fe2++Sn4+,由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是 ( )
A.Sn2+ 、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+ 、Sn2+ D.Fe2+、Sn2+、Ce3+
难度: 中等查看答案及解析
-
下列关于电解质、非电解质的说法正确的是
A.氯气溶于水得氯水,该溶液能导电,因此氯气是电解质
B.CaCO3饱和溶液导电能力很弱,故CaCO3是弱电解质
C.导电能力弱的溶液肯定是弱电解质的溶液
D.HF的水溶液中既有H+、F-,又有大量的HF分子,因此HF是弱电解质
难度: 中等查看答案及解析
-
下列关于钠的说法中,不正确的是 ( )
①钠放置在空气中,会迅速被氧化而生成淡黄色的氧化钠;②钠是银白色金属,熔点低,硬度大③Na是比较活泼的金属,在化学反应中容易失去电子,表现出还原性④两小块质量相等的金属钠,一块在常温下充分反应生成Na2O,另一块在加热的条件下反应生成Na2O2,其中生成Na2O2时转移的电子数多⑤少量钠可保存在煤油里⑥金属钠着火时可用沙子灭火
A.③⑤⑥ B.①②③ C.②④⑤ D.①②④
难度: 中等查看答案及解析
-
下列关于化学实验的说法正确的是
A.某溶液中加入BaCl2溶液,生成白色沉淀,说明原溶液中含有SO42-
B.在蒸馏过程中,发现蒸馏烧瓶中未加沸石或碎瓷片,可以立即加入
C.某溶液中加入硝酸银溶液,生成白色沉淀,说明原溶液中含有Cl-
D.制备Fe(OH)3胶体时,向沸腾的蒸馏水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色,停止加热
难度: 中等查看答案及解析
-
下列有关叙述正确的是( )
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数之比为11:7
B.同体积、同密度的C2H4和CO两种气体的分子数一定相等
C.配制450 mL 0.1 mol﹒L-1NaOH溶液,用托盘天平称取NaOH固体1.8g
D.1L 0.45 mol﹒L-1NaCl溶液中Cl-的物质的量浓度比1 L 0.15 mol﹒L-1 AlCl3溶液大
难度: 中等查看答案及解析
-
质量分数为w,物质的量浓度为c mol﹒L-1的NaCl溶液,蒸发溶剂,恢复到原来的温度,若物质的量浓度变为2c mol﹒L-1,则质量分数变为( )
A.大于2w B.小于2w C.等于2w D.无法确定
难度: 困难查看答案及解析
-
下图表示的一些物质或概念间的从属关系中正确的是
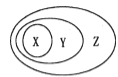
X
Y
A
A
二氧化氮
酸性氧化物
氧化物
B
硫酸
化合物
电解质
C
胶体
分散系
混合物
D
置换反应
氧化还原反应
离子反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
某溶液可能含有以下离子中的若干种:K+、NH4+、Cl-、Ca2+、CO32-、SO42-,现取300 mL溶液平均分为3份进行如下实验:(1)第一份加入AgNO3溶液有沉淀产生;(2)第二份加足量NaOH溶液加热后,收集到标准状况下气体1344 mL(假设气体全部逸出);(3)第三份加足量BaCl2溶液后,得干燥沉淀8.24 g,经足量盐酸洗涤、干燥后,沉淀质量2.33 g。根据上述实验,以下推测正确的是( )
A.Cl-一定存在 B.原溶液CO32-浓度为0.1 mol﹒L-1
C.Ca2+可能存在 D.K+一定存在
难度: 困难查看答案及解析
-
已知2MOyx-+5S2-+16H+=2M2++5S↓+8H2O,则MOyx-中的x的值为
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
关于反应5NH4NO3=2HNO3+4N2↑+9H2O,下列说法中错误的是( )
A.被氧化和与被还原的氮元素的物质的量之比为5:3
B.NH4NO3既是氧化剂又是还原剂
C.若生成4.48 L N2,则转移0.75 mol电子
D.NH4+在反应中体现的性质与反应4NH3+5O2=4NO+6H2O中NH3体现的性质相同
难度: 中等查看答案及解析
-
据说每天早上六点起床默写离子方程式会使人变得更加美丽,而丑陋的人才会被尿憋醒。下列离子反应方程式能正确表示反应的为( )
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.向NaHSO4溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全: Ba2++SO42-+2OH-+2H+=BaSO4↓+2H2O
C.NH4HCO3稀溶液与过量的KOH溶液反应:HCO3-+OH-=CO32-+H2O
D.醋酸除去水垢:2H++CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
下列变化过程中,加人氧化剂才能实现的是
A.Cl2→Cl- B.I-→I2 C.SO2→SO32- D.CuO→Cu
难度: 简单查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在无色溶液中:Na+ Fe3+ Cl— SO42-
B.在含大量Fe3+ 的溶液中:NH4+ K+ NO3- OH-
C.在强碱溶液中:Na+ K+ NO3- CO32—
D.滴加紫色石蕊试剂显红的溶液中:K+ Fe2+ Cl— CO32—
难度: 中等查看答案及解析
-
有一混合溶液,其中只含有Fe2+、Cl-、Br-、I-,其中Cl-、Br-、I-的个数比为2:3:4,向该溶液中通入氯气使溶液中Cl-和Br-的个数比为3:1,则通入氯气的物质的量与溶液中Fe2+剩余的物质的量之比为( )
A.7:4 B.7:3 C.7:2 D.7:1
难度: 困难查看答案及解析
-
下列化学反应属于氧化还原反应,且水做氧化剂的是
A.2F2+2H2O=4HF+O2 B.2Na+2H2O=2NaOH+H2↑
C.CaO+H2O=Ca(OH)2 D.H2+CuO = Cu+H2O
难度: 中等查看答案及解析