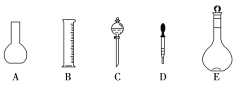
-
下列实验操作均要用玻璃棒,其中玻璃棒作用相同的是 ( )
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶中转移液体
A.①和② B.①和③ C.③和④ D.①和④
难度: 简单查看答案及解析
-
下列状态的物质,既能导电又属于电解质的是
A.MgCl2晶体 B.NaCl溶液 C.液态氯化氢 D.熔融的KOH
难度: 简单查看答案及解析
-
下列分类标准不正确的是( )
A.化学反应分为:氧化还原反应、非氧化还原反应(标准:是否有电子的转移)
B.分散系分为:溶液、胶体、浊液(标准:能否产生丁达尔效应)
C.纯净物分为:单质、化合物(标准:组成物质的元素种数)
D.化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电的化合物)
难度: 中等查看答案及解析
-
下列有关物质分类或归类中,正确的是( )
A.混合物:盐酸、氢氧化铁胶体、氯水、玻璃
B.碱性氧化物:Na2O、MgO、MnO2、K2O
C.电解质:NaHSO4、石墨、CO2、NH4Cl
D.酸性氧化物:CaO、CO2、SiO2、SO3
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.在同温同压时,相同体积的任何气体单质所含的分子数目相同
B.2g氢气所含原子数目为NA
C.在常温常压下, 11.2L氮气所含的原子数目为NA
D.17g氨气所含氢原子数目为NA
难度: 中等查看答案及解析
-
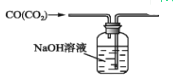
下列图示中正确的实验操作是( )
A. 除去CO中的CO2
 B. 闻气体气味
B. 闻气体气味 C. 稀释浓硫酸
C. 稀释浓硫酸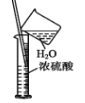 D. 向试管中滴加液体
D. 向试管中滴加液体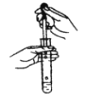
难度: 简单查看答案及解析
-
鉴别SO42-时所选用的试剂及顺序最合理的是( )
A.稀盐酸、BaCl2溶液 B.稀硝酸、BaCl2溶液
C.Ba(NO3)2溶液、稀盐酸 D.BaCl2溶液、稀盐酸
难度: 中等查看答案及解析
-
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700 ℃时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( )
A.金刚石属于金属单质 B.制造过程中元素种类没有改变
C.CCl4是一种化合物 D.这个反应是置换反应
难度: 中等查看答案及解析
-
下列电离方程式错误的是 ( )
A.NaHCO3=Na++H++CO32- B.NaHSO4=Na++H++SO42-
C.Mg(NO3)2=Mg2++2NO3- D.Na2SO4=2Na++SO42-
难度: 简单查看答案及解析
-
为达到下列实验目的,所采用的方法合理的是
A.溴水中提取溴:分液
B.分离水和汽油的混合物:蒸馏
C.分离饱和食盐水和沙子的混合物:过滤
D.从硝酸钾和氯化钠混合液中获取硝酸钾:萃取
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.1mol氧气的质量为32g
B.常温常压下,1molCO2气体体积约为22.4L
C.88gCO2的摩尔质量为44g/mol
D.1L2mol/L的BaCl2溶液中含Cl-的个数为2.408×1024
难度: 中等查看答案及解析
-
欲除去下列物质中的杂质(括号内物质为杂质),所用试剂不正确的是( )
A.KNO3溶液(K2SO4):适量Ba(NO3)2溶液 B.CaCO3粉末(CaCl2):过量盐酸
C.Cu粉(Zn粉):过量盐酸 D.CO2(O2):灼热的铜网
难度: 中等查看答案及解析
-
某元素的原子结构示意图为
,下列关于该原子的说法正确的是( )
A. 核外有3个电子层 B. 最外层电子数为2
C. 核外电子数为7 D. 质子数为7
难度: 中等查看答案及解析
-
下列有关实验操作或判断正确的是
A.配制一定物质的量浓度的溶液,定容时俯视刻度线会导致所配溶液浓度偏小
B.需要95 mL 0.1 mol·L-1NaCl溶液,可选用100 mL容量瓶来配制
C.用100 mL的量筒量取5.2 mL的盐酸
D.用托盘天平称取25.20 g NaCl
难度: 简单查看答案及解析
-
某物质的焰色反应呈黄色,下列判断正确的是( )
A.该物质一定是金属钠 B.该物质一定是钠盐
C.该物质中必定含钠元素 D.该物质中必定含钾元素
难度: 中等查看答案及解析
-
下列反应属于氧化还原反应的是( )
A. SO3+ H2O= H2SO4 B. NH4Cl
NH3
+HCl
C. Fe+CuSO4= FeSO4+Cu D. NaOH+HNO3=NaNO3+H2O
难度: 简单查看答案及解析
-
中国旅游标志马踏飞燕用青铜铸造。关于铜的一种核素
Cu,下列说法正确的是
A.
Cu的中子数为64 B.
Cu的质子数为35
C.
Cu的核电荷数为29 D.
Cu的核外电子数为64
难度: 简单查看答案及解析
-
下列实验结论正确的是( )
A.向某溶液中加入稀盐酸,产生无色无味的气体,将该气体通入澄清石灰水中,石灰水变浑浊,证明该溶液中一定含有CO32-
B.向某溶液中加入稀硝酸和硝酸银溶液,产生白色沉淀,证明该溶液中一定含有Cl-
C.向某溶液中加入CCl4,CCl4层显紫色,证明该溶液中存在I-
D.向某溶液中加入氯化钡溶液,有白色沉淀产生,再加入稀盐酸,沉淀不消失,则该溶液中含有SO42-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列说法中正确的是( )
A.2.4g金属镁变成镁离子时失去的电子数为0.1NA
B.2g氢气中含有的原子数为NA
C.3.01×1023个氮分子中含有的原子数为2NA
D.17g氨气中含有的电子数为10NA
难度: 简单查看答案及解析
-
现有A、B、C三种化合物,各取40g相混合,完全反应后,容器中只有18gB、49gC,还有D生成,已知D的相对分子质量为106。下列说法中不正确的是( )
A.化学方程式一定是A+B=C+D
B.生成D的物质的量为0.5mol
C.若化学方程式为2A+B=C+D,则A的摩尔质量为40g·mol-1
D.若D是碳酸钠,则钠离子的质量为23g
难度: 中等查看答案及解析
-
在我们的日常生活中出现了“加碘食盐”、“增铁酱油”、“高钙牛奶”、“富硒茶叶”和“含氟牙膏”等商品。这里的碘、铁、钙、硒、氟指的是( )
A.元素 B.单质 C.分子 D.氧化物
难度: 简单查看答案及解析
-
用等体积的0.1mol/L的AgNO3溶液,可使相同物质的量浓度的NaCl、MgCl2和AlCl33种溶液中的Cl-恰好完全沉淀,则3种氯化物溶液的体积之比为( )
A.1:2:3 B.3:2:1 C.6:3:2 D.1:1:1
难度: 中等查看答案及解析