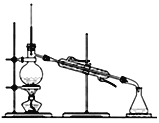
-
检验溶液中是否含有某种离子,下列操作方法正确的是 ( )
A. 向某溶液中加AgNO3溶液产生白色沉淀,证明有Cl-
B. 向某溶液中加稀 HCl,无明显现象,再加入BaCl2 溶液产生白色沉淀,证明有SO42-
C. 向某溶液中加入稀 HCl,放出能使澄清的石灰水变浑浊的气体,证明有CO32-
D. 向某溶液中加入浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明含有NH4+
难度: 中等查看答案及解析
-
2015年12月12日,参加巴黎气候大会的近200个缔约方的代表们通过了一份旨在限制温室气体排放的国际会议,中国为推动达成该协议作出了建设性贡献。下列工业生产中涉及到的化学反应不直接产生温室气体的是( )
A.用焦炭在电炉中还原二氧化硅制取硅单质
B.用煤炭作燃料发电
C.用铁矿石炼铁
D.用纯碱制玻璃
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.烟、云、雾都属于胶体 B.氯化铵、次氯酸都属于强电解质
C.SO2、SiO2、CO 均为酸性氧化物 D.胶体区别于其他分散系的本质原因是丁达尔效应
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数,下列说法正确的是
A.25℃、101kPa下,11.2L CO2和NO2的混合气体中所含的氧原子总数为NA
B.78g Na2O2中含有的阴、阳离子总数是3NA
C.标准状况下,11.2L H2O中含有1.5NA个原子
D.用石灰乳完全吸收1 mol Cl2时,转移电子的数目是2NA
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 一定温度、压强下,气体体积由其分子的大小决定
B. 一定温度、压强下,气体体积由其物质的量的多少决定
C. 气体摩尔体积是指1mol任何气体所占的体积为22.4L
D. 不同的气体,若体积不等,则它们所含的分子数一定不等
难度: 简单查看答案及解析
-
下列有关说法正确的是
A.中子数为10的氧原子:
B.氯原子的结构示意图:
C.原子学说是由汤姆生提出的 D.水的摩尔质量为18
难度: 简单查看答案及解析
-
下列有关电解质的叙述正确的是
A.能在熔化状态下导电的物质,属于电解质
B.在液态不导电的化合物,一定是非电解质
C.固态的硝酸钾不导电是因为没有离子
D.CO2的水溶液能导电,所以H2CO3是电解质
难度: 简单查看答案及解析
-
下列实验操作不正确的是
A.蒸馏操作时,应使温度计水银球的上端与蒸馏烧瓶的支管口下端相平
B.进行分液操作时,应将分液漏斗上口的玻璃塞打开或使塞上的凹槽对准上口颈上的小孔,打开旋塞,使下层液体从漏斗颈下慢慢流出,待下层液体完全流出后,关闭旋塞,上层液体从漏斗上口倒出
C.蒸发操作中,应残留少许液体,停止加热,再利用余热使水分完全蒸干
D.做焰色反应实验所用的铂丝应先蘸稀硫酸,再放在火焰上烧至无色
难度: 简单查看答案及解析
-
对于反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O,以下叙述正确的是
A.Cl2是氧化剂,NaOH是还原剂
B.每生成1mol的NaClO3转移6mol的电子
C.Cl2既是氧化剂又是还原剂
D.被氧化的Cl原子和被还原的Cl原子的物质的量之比为5∶1
难度: 中等查看答案及解析
-
下列几种物质的保存方法中不正确的是
A.碘易升华,可保存在酒精中
B.少量金属钠保存在煤油中
C.氯水通常保存在棕色细口瓶并置于阴凉处
D.在盛液溴的试剂瓶中加水,形成“水封”,以减少溴的挥发
难度: 简单查看答案及解析
-
除去下列物质中的杂质(括号内为杂质),所选用的试剂及操作方法不正确的是
选项
待提纯的物质
选用试剂
操作的方法
A
FeCl2溶液(FeCl3溶液)
铁粉
过滤
B
SiO2(CaO)
H2O
过滤
C
CO2(HCl)
饱和NaHCO3溶液
洗气
D
Na2CO3固体(NaHCO3固体)
——
加热至质量不再变化
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列关于氯气的叙述中,不正确的是( )
A.氯气是一种有毒的气体 B.氯气、氯水、液氯是同一种物质
C.氯气与水的反应是可逆反应 D.氯气是一种黄绿色,有刺激性气味的气体
难度: 简单查看答案及解析
-
碳酸钠和碳酸氢钠的化学性质有许多相似的地方,但也存在差异,以下关于两者性质的比较正确的是
A.两者水溶液均呈碱性,碳酸钠俗名纯碱,物质分类属于碱
B.两者均和稀盐酸反应产生CO2,但碳酸氢钠和盐酸反应更剧烈
C.用酒精灯加热时两者均可发生分解反应,但碳酸氢钠更易分解
D.两者均可和澄清石灰水发生反应,但碳酸氢钠反应时无沉淀
难度: 简单查看答案及解析
-
某硫原子的质量是ag,12C原子的质量是bg,若NA只表示阿伏加德罗常数的数值,则下列说法中正确的是( )
①该硫原子的相对原子质量为
②mg该硫原子的物质的量为
mol
③该硫原子的摩尔质量是aNA g ④ag该硫原子所含的电子数为16NA
A. ①③ B. ②④ C. ①② D. ②③
难度: 简单查看答案及解析
-
利用海水提取溴和镁的过程如下,下列说法不正确的是
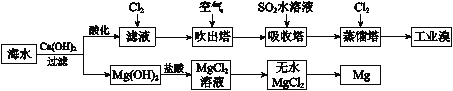
A.工业溴中含少量Cl2,可用NaOH溶液除去
B.工业上常利用电解熔融MgCl2冶炼金属镁
C.富集溴元素过程中,空气吹出法利用了溴易挥发的性质
D.若提取1 mol Br2,至少需要标准状况下44.8 L的Cl2
难度: 中等查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的溶液中:Na+、K+、MnO4-、CO32-
B.使酚酞试液变红的溶液中:Mg2+、Cu2+、SO42-、NO3-
C.0.1mol/LNH4HCO3溶液中:K+、Na+、NO3-、Cl-
D.0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42-
难度: 简单查看答案及解析
-
下列方程式表达,正确的是
A.碳酸氢钠溶于水的电离方程式:NaHCO3
Na++H++CO32-
B.氯气与水反应:Cl2 + H2O
2H+ + Cl- + ClO-
C.氢氧化钡溶液与稀硫酸混合:Ba2++ OH- + SO42- + H+ = BaSO4↓ + H2O
D.向FeI2溶液中通入少量的氯气:2I-+Cl2 = 2Cl-+I2
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.氧化还原反应中有一种元素被氧化时,一定有另一种元素被还原
B.含有最低价态元素的化合物不一定具有很强的还原性
C.阳离子只能得电子被还原,阴离子只能失电子被氧化
D.在化学反应中,得电子数越多的氧化剂,其氧化性越强
难度: 简单查看答案及解析
-
下列关于硅单质及其化合物的说法中错误的是
A.陶瓷、玻璃、水泥、水晶饰品等,都是硅酸盐产品
B.常温下,单质硅的性质稳定,与氧气、氯气、硝酸、硫酸等都很难发生反应
C.水玻璃可以作为粘合剂、木材防腐剂
D.青花瓷胎体的原料为高岭土[Al2Si2O5(OH)4],若以氧化物形式可表示为:Al2O3·2SiO2·2H2O
难度: 简单查看答案及解析
-
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.SO2和FeSO4溶液使酸性高锰酸钾的紫色褪去
C.亚硫酸钠溶液和水玻璃长期暴露在空气中变质
D.二氧化硫和氯水使品红溶液褪色
难度: 简单查看答案及解析
-
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,在一定的条件下,它们之间具有如下转化关系:
。下列有关物质的推断不正确的是
A.若甲为焦炭,则丁可能是O2 B.若甲为Fe,则丁可能是氯气
C.若甲为Fe,则丁可能是硝酸 D.若甲为NaOH 溶液,则丁可能是CO2
难度: 简单查看答案及解析
-
在酸性高锰酸钾溶液中加入Na2O2粉末,高锰酸钾溶液褪色,其中发生反应的离子方程式为:2MnO4-+16H++ 5Na2O2= 2Mn2++5O2↑ + 8H2O + 10Na+ 下列判断正确的是:
A.高锰酸钾是氧化剂,Na2O2既是氧化剂,又是还原剂
B.反应的氧化产物只有氧气
C.当反应产生标准状况下2.24 L O2时,反应转移的电子为0.1mol
D.通常所说的酸化的高锰酸钾溶液是指滴加了浓盐酸的高锰酸钾溶液
难度: 中等查看答案及解析
-
将一定量的Fe、Fe2O3、CuO的混合物放入体积为l00mL、浓度为2.2mol·L-1的H2SO4溶液中,充分反应后,生成气体 896mL(标况),得到不溶固体1.28 g,过滤后,滤液中的金属离子只有Fe2+(假设滤液体积仍为 100mL)。向滤液中滴加 2mol·L-1的 NaOH溶液至40mL时开始出现沉淀。则未滴加 NaOH溶液前,滤液中 FeSO4的物质的量浓度为
A.2 mol·L-1 B.l.8 mol·L-1 C.1.9 mol·L-1 D.无法计算
难度: 中等查看答案及解析
-
今有一混合物的水溶液,可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Ba2+、CO32-、SO42-,现取三份各100mL溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。根据上述实验,以下推测正确的是
A.无法确定K+是否存在 B.100mL溶液中含0.01mol CO32-
C.Ba2+一定不存在,Mg2+可能存在 D.Cl-可能存在
难度: 中等查看答案及解析

 b
b c
c d
d