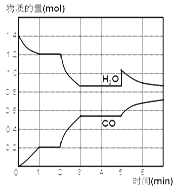
-
能源与我们的日常生活密切相关,下列有关能源的叙述中错误的是
A.我国目前使用的主要能源是化石燃料,属于可再生能源
B.科学家正在研究开发太阳能、风能、潮汐能等新能源,并取得了一定进展
C.提高燃料的燃烧效率对于节约能源十分重要
D.利用晶体硅制作的太阳能电池将太阳能直接转化为电能
难度: 简单查看答案及解析
-
CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是
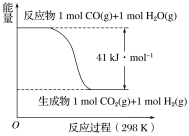
A.该反应为吸热反应
B.1 mol CO(g)和1 mol H2O(g)具有的总能量大于1 mol CO2(g)和1 mol H2(g)具有的总能量
C.该反应不需要加热就能进行
D.1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量
难度: 简单查看答案及解析
-
甲醇属于可再生能源,可作汽车的燃料,下列能正确表示甲醇燃烧热的热化学方程式为
A.CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=+763.3 kJ·mol-1
B.CH3OH(l)+
O2(g)=CO2(g)+2H2O(l) ΔH=-763.3 kJ·mol-1
C.CH3OH(l)+
O2(g)=CO2(g)+2H2O(g) ΔH=-675.3 kJ·mol-1
D.2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1 526.6 kJ·mol-1
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中进行反应:A(s)+2B(g)
C(g)+D(g),不能说明该反应已达到化学平衡的是
A.B的体积分数不随时间变化而变化
B.压强不随时间变化而变化
C.混合气体的密度不再发生改变
D.单位时间内生成n mol A,同时生成n molC
难度: 中等查看答案及解析
-
反应C(固)+H2O(气)
CO2(气)+H2(气)在一可变容积的密闭容器中进行,下列条件改变对其反应速率几乎无影响的是
A.增加C的量 B.将容器的体积缩小一半
C.保持体积不变,充入H2 D.压强不变充入N2使体积增大
难度: 中等查看答案及解析
-
把下列4种X溶液,分别加入4个盛有10mL 2mol·L-1 盐酸的烧杯中,均加水稀释到50mL,此时X和盐酸缓慢地进行反应。其中反应速率最大的是
A.20mL 2mol·L-1 的X溶液 B.10mL 4mol·L-1 的X溶液
C.20mL 4mol·L-1 的X溶液 D.10mL 3mol·L-1 的X溶液
难度: 中等查看答案及解析
-
某温度时,反应SO2(g)+1/2O2(g)
SO3(g)的平衡常数K=50。在同一温度下,反应2SO3(g)
2SO2 (g)+O2(g)的平衡常数K1应为( )
A.2 500 B.100 C.4×10-4 D.2×10-2
难度: 中等查看答案及解析
-
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示,下列描述正确的是
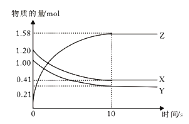
A.反应开始到10s,用Z表示的平均反应速率为0.158 mol/(L·s)
B.反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C.反应的化学方程式为:X(g)+Y(g)
Z(g)
D.反应开始到10s时,Y的转化率为79.0%
难度: 中等查看答案及解析
-
一定温度下,在体积为VL的密闭容器中加入1 molX和1 molY进行如下反应: X(g)+Y(g)
2Z(g)+W(s) △H>0达到平衡,下列判断正确的是
A.向平衡混合物中加入少量W,正、逆反应速率均增大
B.平衡后加入催化剂,上述反应的△H增大
C.温度不变,将容器的体积变为2VL,Z的平衡浓度变为原来的
D.升高温度,平衡逆向移动
难度: 中等查看答案及解析
-
对于可逆反应mA(s)+nB(g)
eC(g)+fD(g),当其他条件不变时,C的体积分数[φ(C)]在不同温度(T)和不同压强(p)下随时间(t)的变化关系如图所示。下列叙述正确的是( )
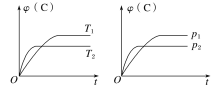
A.达到平衡后,若使用催化剂,C的体积分数将增大
B.该反应的ΔH<0
C.化学方程式中,n>e+f
D.达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
难度: 中等查看答案及解析