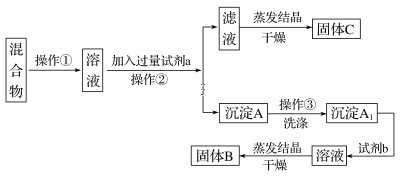
-
在下列条件下,两种气体的分子数一定相等的是
A. 同密度、同压强的 N2 和 C2H4 B. 同温度、同体积的 O2 和 N2
C. 同体积、同密度的 C2H4 和 CO D. 同压强、同体积的 O2 和 N2
难度: 中等查看答案及解析
-
核电由于资源消耗少、环境影响小、供应能力强,与火电、水电并称世界三大电力供应支柱。然而科技是把双刃剑,2011年日本发生9级地震并引发海啸,福岛核电站险情不断,危害极大。下列图标中警示放射性物品的是
A.
 B.
B. C.
C. D.
D.
难度: 简单查看答案及解析
-
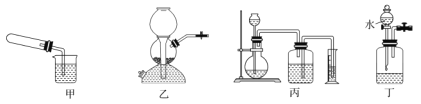
下列实验操作中正确的是
A.用25mL量筒量取4.0mol·L-1的盐酸5.62mL
B.做蒸馏操作时,冷凝水方向是下进上出
C.用溶解、过滤、蒸发的方法分离氯化钠与硝酸钾的混合物
D.用蒸发皿灼烧胆矾(CuSO4•5H2O)得到CuSO4
难度: 中等查看答案及解析
-
下列实验装置或操作与微粒的大小无直接关系的是( )
A.过滤
 B.渗析
B.渗析
C.萃取
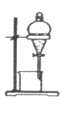 D.丁达尔效应
D.丁达尔效应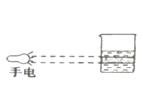
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A.物质的量是一个物理量,表示含有一定数目粒子的集合体
B.阿伏加德罗常数的符号NA,通常用6.02×1023表示
C.标准状况下,分子数相同的任何气体都具有相同的体积
D.摩尔质量是单位物质的量的物质所具有的质量
难度: 中等查看答案及解析
-
下列关于配制一定物质的量浓度溶液的说法,正确的组合是( )
①托盘天平可读取到小数点后一位(以克为单位),容量瓶可精确到小数点后两位(以毫升为单位)
②托盘天平只能粗略地称量物质的质量,量筒只能粗略地量取液体的体积,严格地说,它们都不能与容量瓶——精确仪器配套使用
③量筒内的残液必须冲洗下来,倒入容量瓶中
④称量的固体(或量取的液体)可直接放入容量瓶中溶解(或稀释)
⑤引流时,玻璃棒不能靠在瓶口上
⑥定容摇匀后,若液面低于刻度线,可再次加水补齐
A. ①②⑤ B. ①③④
C. ②④⑥ D. ④⑤⑥
难度: 简单查看答案及解析
-
下列溶液中n(Cl-)与50mL 1 mol/L的AlCl3溶液中的n(Cl-)相等的是( )
A.150mL1mol/LNaCl B.75mL2mol/LCaCl2
C.150mL1mol/LKClO3 D.75mL1mol/LFeCl3
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.煮沸FeCl3饱和溶液可以制取Fe(OH)3胶体
B.鸡蛋清、浑浊的河水不可能属于同一类别
C.氢氧化铁胶体带正电
D.直径为10-8m的微粒不一定属于胶体
难度: 中等查看答案及解析
-
分类是化学研究中常用的方法.下列分类方法中,正确的是
A.依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等
B.NH4Cl组成中不含金属离子,不属于盐
C.硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
D.依据组成元素的种类,将纯净物分为单质和化合物
难度: 简单查看答案及解析
-
下列各组物质中,所含分子数一定相同的是( )
A.1 g H2和8 g O2
B.0.1 mol HCl和2.24 L He
C.150 ℃,1.01×105 Pa时,18 L H2O和18 L CO2
D.常温常压下,28 g CO和6.02×1022个CO分子
难度: 中等查看答案及解析
-
M表示摩尔质量,NA表示阿伏加德罗常数,Vm表示气体摩尔体积,ω表示溶质的质量分数,ρ(单位为g•cm-3)表示溶液的密度。下列说法中不正确的是( )
A.根据摩尔质量和阿伏加德罗常数可以计算得出某气体分子的质量:
B.根据气体摩尔体积和阿伏加德罗常数可以计算得出该条件下某气体分子的大小:
C.根据摩尔质量和气体摩尔体积可以计算得出该条件下某气体的密度:
D.根据溶质的质量分数、摩尔质量和溶液的密度可以计算出某溶液的物质的量浓度:
难度: 困难查看答案及解析
-
利用实验器材(规格和数量不限)能完成相应实验的一项是( )
选项
实验器材(省略夹持装置)
相应实验
A
烧杯、玻璃棒、蒸发皿
CuSO4溶液的浓缩结晶
B
烧杯、玻璃棒、胶头滴管、滤纸
用盐酸除去BaSO4固体中少量BaCO3固体
C
烧杯、玻璃棒、胶头滴管、容量瓶
用NaCl固体配制0.5mol/L的溶液
D
烧杯、玻璃棒、分液漏斗
用CCl4除去NaCl溶液中少量的Br2
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
在两个容积相同的容器中,一个盛有NO气体,另一个盛有N2和O2的混合气体。在同温同压下,两容器内的气体一定具有相同的
A.质子数 B.原子数 C.密度 D.质量
难度: 简单查看答案及解析
-
关于某溶液所含离子检验方法和结论正确的是
A.加入Na2CO3溶液,有白色沉淀生成,则原溶液中一定含有Ca2+
B.加入AgNO3溶液有白色沉淀生成,加稀盐酸沉淀不消失,则原溶液中一定含有Cl-
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液中一定含有SO42-
D.加入盐酸产生能使澄清石灰水变浑浊的无色无味气体,则原溶液中CO32-或HCO3-
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.17gH2O2与17gH2S所含的电子数均为9NA
B.在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA
C.1mol/L Na2SO4溶液含有2NA个Na+
D.若0.1molFeCl3在水中完全形成Fe(OH)3胶体,则胶粒数目为0.1NA
难度: 中等查看答案及解析
-
欲配制100mL1.0 mol/L Na2SO4溶液,正确的方法是( )
①将14.2 g Na2SO4,溶于100mL水中
②将32.2g Na2SO4•10H2O溶于少量水中,再用水稀释至100 mL
③将20 mL 5.0 mol/L Na2SO4溶液用水稀释至100 mL
A.①② B.②③ C.①③ D.①②③
难度: 中等查看答案及解析
-
将15 mL 2 mol/L AgNO3溶液逐滴加入到20 mL 0.5 mol/L MCln盐溶液中,恰好使溶液中的Cl-完全沉淀,则MCln中n的值是
A.1 B.2 C.3 D.4
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
①16gCuSO4·5H2O 溶于1L水所得溶液的物质的量浓度为0.1mol/L
②标准状况下,11.2L H2和14g N2所含原子数相同
③1 mol的Cl﹣含有NA个电子
④1mol粒子集合体所含的粒子数与0.012kg C中所含的碳原子相同
⑤同温同体积时,气体物质的物质的量越大,则压强越大
⑥同温同压下,气体的密度与气体的相对分子质量成正比
A.①②③ B.②⑤⑥ C.②④⑤⑥ D.①②④⑤
难度: 困难查看答案及解析
-
若以ω1和ω2分别表示浓度为amol•L-1和bmol•L-1氨水的质量分数,且2a=b,则下列推断正确的是(氨水的密度比纯水小)( )
A.2ω2=ω1 B.2ω1=ω2 C.ω2>2ω1 D.ω1<ω2<2ω1
难度: 中等查看答案及解析
-
由CO2、H2和CO组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2和CO的体积比可能为( )
A.13:8:29 B.22:1:14 C.29:8:13 D.44:2:23
难度: 中等查看答案及解析