-
化学与生产、生活、科技、环境等密切相关,下列说法不正确的是( )
A. Al2O3和MgO的熔点均很高,可用于制作耐高温材料
B. 将“地沟油”制成肥皂,可以提高资源的利用率
C. 小苏打和氢氧化铝胶囊可以作内服药治疗胃酸过多
D. 半导体行业中有一句话:“从沙滩到用户”,计算机芯片的材料是二氧化硅
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 1 mol Fe与过量稀HNO3反应,电子转移数为3NA
B. 常温下,1 L 0.5 mol/L NH4Cl溶液与2 L 0.25 mol/L NH4Cl溶液所含NH4+的数目均为0.5NA
C. 标准状况下,22.4 L己烷含有的共价键总数为19NA
D. 100 g质量分数为17%的H2O2水溶液中含氧原子数目为0.5NA
难度: 中等查看答案及解析
-
a、b、c、d、e五种短周期元素的原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )
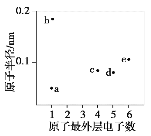
A. 简单离子半径:b>e
B. 常温常压下,a与c形成的化合物可能呈固态
C. 单质沸点:c<d
D. d与e不能存在于同一离子化合物中
难度: 中等查看答案及解析
-
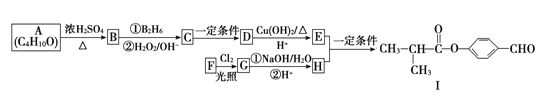
香草醛是一种广泛使用的可食用香料,可通过如下方法合成。
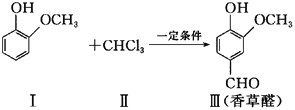
下列说法正确的是 ( )
A. 物质Ⅰ的分子式为C7H7O2
B. CHCl3分子具有正四面体结构
C. 物质Ⅰ的同分异构体中可以既含苯环又含羧基
D. 香草醛可发生取代反应、加成反应
难度: 中等查看答案及解析
-
下列图示的实验操作,能实现相应实验目的的是 ( )
A. 蒸干CuCl2饱和溶液制备无水CuCl2
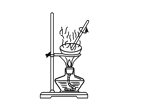
B. 实验室制取并收集少量纯净氯气
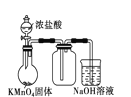
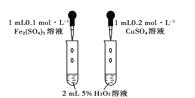
C. 研究催化剂对H2O2分解速率的影响
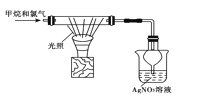
D. 验证甲烷和氯气在光照条件下发生取代反应
难度: 简单查看答案及解析
-
我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2===H2O2+S,已知甲池中发生反应:
 。
。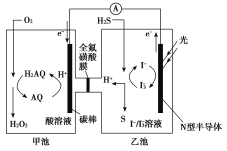
下列说法正确的是( )
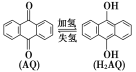
A. 甲池中碳棒上发生的电极反应为AQ+2H+-2e-===H2AQ
B. 乙池溶液中发生的反应为H2S+I3-===3I-+S+2H+
C. 该装置中电能转化为光能
D. H+从甲池移向乙池
难度: 困难查看答案及解析
-
生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:
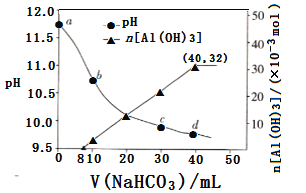
下列有关说法不正确的是( )
A. 原NaHCO3溶液中 c(H2CO3)+c(HCO3-)+c(CO32-)=0.8mol/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+c(OH-)
D. 生成沉淀的离子方程式为: AlO2-+HCO3-+H2O =Al(OH)3↓+CO32-
难度: 中等查看答案及解析
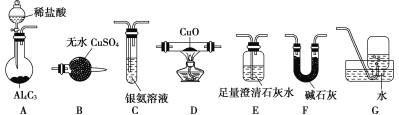
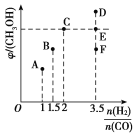
 已知以下信息:
已知以下信息: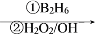 R—CH2CH2OH;
R—CH2CH2OH;