-
物质的量浓度相同的下列各溶液,由水电离出的c(OH-)由大到小的顺序正确的是
①NaHCO3 ②NaHSO4 ③Na2SO4 ④Na2CO3
A. ①②③④ B. ④③①② C. ④①③② D. ①④③②
难度: 简单查看答案及解析
-
化学知识在生产和生活中有着重要的应用。下列说法中,错误的是
A. 明矾常作为净水剂,双氧水通常可用于作杀菌消毒
B. 金属钠、镁等活泼金属着火时,不能使用泡沫灭火器来灭火
C. 误食重金属盐引起的人体中毒,可以喝大量的浓盐水解毒
D. 发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔
难度: 简单查看答案及解析
-
关于强弱电解质及非电解质的组合完全正确的是( )
选项
①
②
③
④
强电解质
NaCl
H2SO4
CaCO3
HNO3
弱电解质
HF
BaSO4
HClO
CH3COOH
非电解质
Cl2
CS2
蔗糖
H2CO3
A.① B.② C.③ D.④
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列说法中正确的是( )
A. 标准状况下,22.4LH2O含有NA个分子
B. 5.6g铁与足量盐酸反应转移的电子数为0.2NA
C. 等物质的量浓度的盐酸和硫酸中,H+的物质的量浓度也相等
D. 1mol/L MgCl2溶液中含有Cl﹣的数目为2NA
难度: 中等查看答案及解析
-
下列方程式中,能够正确表示水解反应的是
A.HCO3—+H2O
CO32—+H3O+ B.S2—+2H2O
H2S+2OH—
C.CO2+H2O
HCO3—+H+ D.CO32—+H2O
HCO3—+ OH—
难度: 中等查看答案及解析
-
中和相同体积、相同pH值的H2SO4、HCl和CH3COOH三种稀溶液,所需相同浓度的NaOH溶液的体积为V1、V2和V3,则( )
A.V1>V2>V3 B.V3>V2>V1
C.V3>V1=V2 D.V1>V2=V3
难度: 中等查看答案及解析
-
下列有关实验的选项正确的是
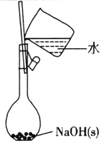
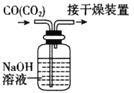
A.配制0.l0mol/L NaOH溶液
B.除去CO中的CO2
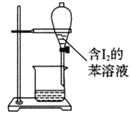
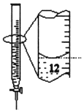
C.苯萃取碘水中的I2,分出水层后的操作
D.记录滴定终点读数为12.20mL
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
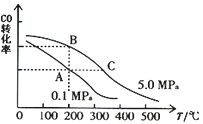
在密闭容中发生下列反应aA(g)
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.8倍,下列叙述正确的是
A. A的转化率变大 B. 平衡向正反应方向移动
C. D的体积分数变大 D. a<c+d
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中一定能大量共存的是
①pH=0的溶液:Na+、I-、NO3-、SO42-
②pH=12的溶液中:CO32-、Na+、NO3-、S2-、SO32-
③水电离的H+浓度c(H+)=10-12 mol·L-1的溶液中:Cl-、CO32-、NO3-、NH4+、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-
⑤使石蕊变红的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
A.②④ B.只有② C.①②⑤ D.①②
难度: 中等查看答案及解析
-
下列说法不能用勒夏特列原理解释的是( )
A.对于CO(g)+NO2(g)
CO2(g)+NO(g)的平衡体系,增大压强可使颜色变深
B.氢气和氮气合成氨的反应中,在加压下有利于氨的生成
C.开启可乐瓶,瓶中马上泛起大量气泡
D.利用排液法收集氯气时常用液体为饱和食盐水
难度: 简单查看答案及解析
-
25℃时,纯水中存在的平衡:H2O
H+ + OH-,下列叙述正确的是
A.将水加热,Kw增大,pH不变
B.加入稀盐酸,平衡逆向移动,c(H+)降低
C.加入氢氧化钠溶液,平衡逆向移动,Kw变小
D.加入少量固体CH3COONa,平衡正向移动,c(H+)降低
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.将铜插入稀硝酸中:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
B.向Fe2(SO4)3溶液中加入过量铁粉:Fe3++Fe=2Fe2+
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是
A. 10 L 0.1mol·L-1氨水与10 L 0.1mol·L-1盐酸混合: [Cl-]>[NH4+]>[OH-]>[H+]
B. 10mL0.1mol·L-1NH4Cl溶液与5mL 0.2 mol·L-1 NaOH溶液混合:[Na+]=[Cl-]>[OH-]>[H+]
C. 10mL0.1mol·L-1CH3COOH溶液与5 mL0.2 mol·L-1 NaOH溶液混合:[Na+]=[CH3COO-] >[OH-] >[H+]
D. 10mL 0.5mol·L-1CH3COONa溶液与 6 mL1mol·L-1盐酸混合:[Cl-]>[Na+]>[OH-]>[H+]
难度: 中等查看答案及解析
-
对下列现象或事实的解释正确的是
选项
现象或事实
解释
A
蒸发NaAlO2溶液可以获得固体NaAlO2
NaAlO2在水中不会水解
B
施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用
K2CO3与NH4Cl反应生成氨气会降低肥效
C
漂白粉在空气中久置变质
漂白粉中的ClO-可以水解成HClO
D
FeCl3溶液可用于水处理
FeCl3中Fe3+具有氧化性可杀菌消毒
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列滴定中,指示剂的选择或滴定终点颜色变化有错误的是( )
提示:2KMnO4+5K2SO3+3H2SO4=6K2SO4+2MnSO4+3H2O、I2+Na2S=2NaI+S↓
选项
滴定管中的溶液
锥形瓶中的溶液
指示剂
滴定终点颜色变化
A
NaOH溶液
CH3COOH溶液
酚酞
无色→浅红色
B
HCl溶液
氨水
甲基橙
黄色→橙色
C
酸性KMnO4溶液
K2SO3溶液
无
无色→浅紫红色
D
碘水
Na2S溶液
淀粉
蓝色→无色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
在25ºC时,在0.01mol·L-1的盐酸溶液中,水电离出的H+浓度是
A.5×10-13mol·L-1 B.0.02mol·L-1
C.1×10-7mol·L-1 D.1×10-12mol·L-1
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污 B.粗盐在空气中易潮解
C.加热氯化铁溶液颜色变深 D.浓硫化钠溶液有臭味
难度: 简单查看答案及解析
-
某密闭容器中发生反应:X(g)+3Y(g)
2Z(g) ΔH<0。如图表示该反应的速率(v)随时间(t)变化的关系,t2、t3、t5时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中正确的是( )
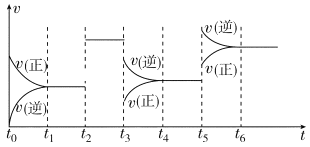
A.t2时加入了催化剂 B.t3时降低了温度
C.t5时增大了压强 D.t4~t5时间内X转化率最低
难度: 中等查看答案及解析
-
ClO2是一种消毒杀菌效率高、二次污染小的水处理剂。可通过以下反应制得ClO2:2KClO3+H2C2O4+H2SO4
2ClO2↑+K2SO4+2CO2↑+2H2O,下列说法正确的是
A.KClO3在反应中失去电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KClO3参加反应有2 mol电子转移
难度: 简单查看答案及解析
-
在25℃时,10mL pH=a的盐酸中,滴加pH=b的NaOH溶液100 mL时,溶液中Cl-的物质的量恰好等于Na+的物质的量,则a+b的值是
A.13 B.14 C.15 D.无法确定
难度: 中等查看答案及解析