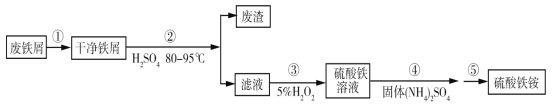
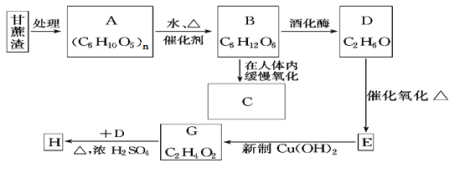
-
化学与生活密切相关,下列叙述错误的是
A. 活性炭具有除异味和杀菌作用
B. 高纯硅可用于制作光感电池
C. 中国天眼FAST用到的碳化硅是一种新型的无机非金属材料
D. 碘酒可用于皮肤外用消毒
难度: 简单查看答案及解析
-
关于化合物2-苯基丙烯(
),下列说法正确的是
A. 不能使酸性高锰酸钾溶液褪色
B. 易溶于水及甲苯
C. 分子中所有原子共平面
D. 可以发生加成聚合反应
难度: 中等查看答案及解析
-
为实现随处可上网,中国发射了“中星16号”卫星。NH4ClO4是火箭的固体燃料,发生反应为2NH4ClO4
N2↑+Cl2↑+2O2↑+4H2O,NA代表阿伏加德罗常数,下列说法正确的是
A. 1 mol NH4ClO4溶于水含NH4+和ClO4-离子数均为NA
B. 反应中还原产物分子数与氧化产物分子总数之比为1:3
C. 产生6.4g O2反应转移的电子总数为0.8NA
D. 0.5mol NH4ClO4分解产生的气体体积为44.8L
难度: 中等查看答案及解析
-
下列除杂试剂选用正确且除杂过程不涉及氧化还原反应的是
物质(括号内为杂质)
除杂试剂
A
FeCl2溶液(FeCl3)
Fe粉
B
NaCl溶液(MgCl2)
NaOH溶液、稀HCl
C
Cl2(HCl)
H2O、浓H2SO4
D
NO(NO2)
H2O、无水CaCl2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值,下列说法错误的是( )
A. 4.6g由NO2和N2O4组成的混合气体中含有的原子总数为0.3NA
B. 0.2gD216O中含有的质子数,中子数,电子数均为0.1NA
C. 6.2克白磷分子(P4)中含P—P键为0.05NA
D. 铁与足量稀硝酸反应时,生产0.1molNO转移的电子数为0.3NA
难度: 中等查看答案及解析
-
室温下,用
溶液分别滴定
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
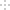
A.Ⅱ表示的是滴定醋酸的曲线
B.
时,滴定醋酸消耗的
小于
C.
时,两份溶液中
D.
时,醋酸溶液中
难度: 中等查看答案及解析
-
图甲为一种新型污水处理装置,该装置可利用一种微生物将有机废水的化学能直接转化为电能。图乙为电解氯化铜溶液的实验装置的一部分。下列说法中正确的是
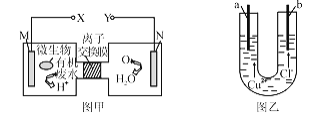
A. a极要与Y极连接
B. N电极发生还原反应,当N电极消耗5.6L(标准状况下)气体时,则a电极增重64g
C. 不论b为何种电极材料,b极的电极反应式一定为2C1--2e-=Cl2↑
D. 若有机废水中主要含有乙醛,则图甲中M极发生的电极应为:CH3CHO+3H2O-l0e-=2CO2↑+l0H+
难度: 困难查看答案及解析