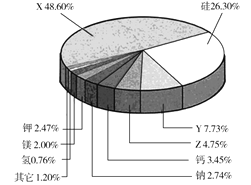
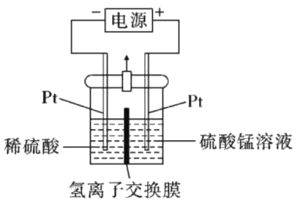
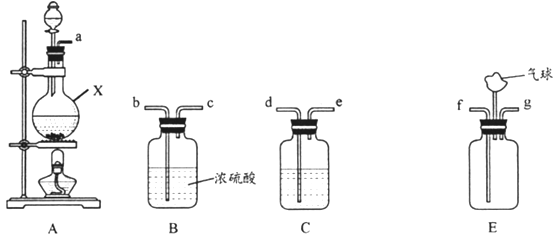
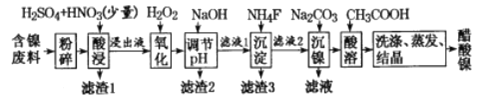
-
中华民族的发明创造为人类文明进步做出了巨大贡献。下列物质主要成分是有机物的是( )
A.
 茅台酒 B.
茅台酒 B. 景德镇瓷器
景德镇瓷器C.
 华新水泥 D.
华新水泥 D. 铸造后母戊鼎
铸造后母戊鼎难度: 简单查看答案及解析
-
2007年2月,中国首条“生态马路”在上海复兴路隧道建成,它运用了“光触媒”技术,在路面涂上一种光催化剂涂料,可将汽车尾气中45%的NO和CO转化成N2和CO2。下列对此反应的叙述中正确的是( ).
A. 使用光催化剂不改变反应速率 B. 使用光催化剂能增大NO的转化率
C. 升高温度能加快反应速率 D. 改变压强对反应速率无影响
难度: 简单查看答案及解析
-
下列实验操作正确的是
实验
操作
A
证明某溶液中存在 Fe3+
先加少量氯水,再滴加 KSCN 溶液,出现血红色
B
除去 NaCl溶液中存在的 Na2SO3
向该溶液中加入适量的稀硝酸
C
分离氢氧化铝和氢氧化镁的混合物
将混合物溶于适量氢氧化钠溶液,过滤得Mg(OH)2;向滤液中通入过量氯化氢,过滤得Al(OH)3
D
制备氢氧化铁胶体
将少量饱和 FeCl3 溶液滴加入沸水中继续煮沸至溶液呈红褐色
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是 ( )
A.磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3- =3Fe3++NO↑+3H2O
B.向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
C.向Fe(NO3)3溶液中加入过量的HI溶液:2NO3-+8H++6I- =3I2+2NO↑+4H2O
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3 =2FeO42-+3Cl-+H2O+4H+
难度: 中等查看答案及解析
-
石墨烯电池是利用锂离子在石墨烯表面和电极之间快速大量穿梭运动的特性而研发的新型可充放电电池,其反应式为LixC6+Li1-xCoO2
C6+LiCoO2,其工作原理如下图所示。下列关于该电池的说法正确的是( )
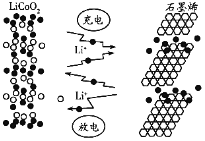
A. 充电时,
嵌入
中
B. 放电时,
极发生的电极反应为
C. 放电时负极反应为:
D. 充电时,若转移
,石墨烯电极增重7g
难度: 中等查看答案及解析
-
交联聚合物P的结构片段如图所示。下列说法不正确的是(图中
表示链延长)


A.聚合物P中有酯基,能水解 B.聚合物P的合成反应为缩聚反应
C.邻苯二甲酸和乙二醇在聚合过程中也可形成类似聚合物P的交联结构 D.聚合物P的原料之一丙三醇可由油脂水解获得
难度: 中等查看答案及解析
-
某100mL溶液可能含有Na+、
、Fe3+、
、
、Cl-中的若干种,取该溶液进行连续实验,实验过程如图(所加试剂均过量,气体全部逸出)。下列说法正确的是( )
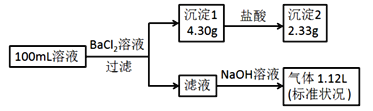
A.原溶液一定存在
和
,一定不存在 Fe3+
B.原溶液可能存在 Cl- 和 Na+
C.原溶液中 c(
)是 0.01mol•L-1
D.若原溶液中不存在 Na+,则 c(Cl-)<0.1mol•L-1
难度: 困难查看答案及解析