-
下列环境问题与所对应的物质不相关的是( )
A. 温室效应——二氧化碳 B. 光化学烟雾——二氧化氮
C. 酸 雨——二氧化硫 D. 臭氧层破坏——一氧化碳
难度: 简单查看答案及解析
-
C和Si 是同主族元素,最外层电子数相同,性质相似。下列关于CO2与SiO2说法中正确的是( )
A. CO2能与水反应生成对应的酸;SiO2也能与水反应生成对应的酸
B. CO2的结构式是O=C=O;SiO2的结构式是O=Si=O
C. CO2分子由1个C原子和2个O原子构成;SiO2分子由1个Si原子和2个O原子构成
D. CO2具有氧化性,可作氧化剂;SiO2也具有氧化性,可作氧化剂
难度: 简单查看答案及解析
-
下列说法中正确的是( )
A. 次外层电子数是2或8或18的原子一定是主族元素
B. 短周期元素中最外层电子数等于电子层数的元素有2种
C. L层上的电子数为奇数的原子一定是主族元素的原子
D. 核外电子排布相同的微粒,一定具有相同的化学性质
难度: 简单查看答案及解析
-
下列化学用语表示正确的是( )
A. N2的电子式:
B. 次氯酸的结构式:H-Cl-O
C. CO2的比例模型:
 D. S2-的结构示意图:
D. S2-的结构示意图:难度: 简单查看答案及解析
-
下列只含有共价键的化合物是( )
A. NH4NO3 B. Cl2 C. HCl D. NaOH
难度: 简单查看答案及解析
-
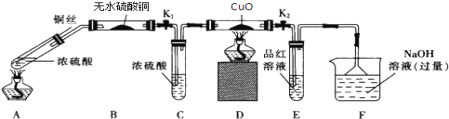
下列装置用于实验室中制取干燥氨气的实验,能达到实验目的的是
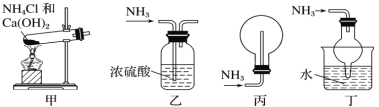
A. 用装置甲制备氨气
B. 用装置乙除去氨气中少量水
C. 用装置丙收集氨气
D. 用装置丁吸收多余的氨气
难度: 简单查看答案及解析
-
下列变化中,不需要破坏化学键的是( )
A. 氯化氢溶于水 B. 加热碘化氢气体使其分解
C. 冰融化 D. 加热纯碱晶体使之熔化
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 1L 0.1 mol/L氨水中含有0.1NA NH3分子
B. 46g NO2和N2O4混合气体中含有的原子数为3NA
C. 1mol Na2O2中含有的阴离子数为2NA
D. 常温常压下,12g 14C所含原子数为NA
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 共价化合物中一定含有共价键,可能含有离子键
B. 离子化合物中一定含有离子键,可能含有共价键
C. 熔融状态下能导电的物质一定是离子化合物
D. 只含有非金属元素的物质一定是共价化合物
难度: 简单查看答案及解析
-
下列离子反应方程式正确的( )
A. 实验室用固体氯化铵和熟石灰共热制取NH3:2NH4++Ca(OH)2
2NH3↑+ Ca2++2H2O
B. 铜与浓硝酸反应: 3Cu + 8H+ + 2NO3- =3Cu2+ + 2NO↑ + 4H2O
C. 氨水与FeCl3反应:3OH- + Fe3+ =Fe(OH)3↓
D. 用碳酸钠溶液吸收少量二氧化硫:2CO32-+SO2+H2O===2HCO
+SO32-
难度: 简单查看答案及解析
-
硝酸工业尾气中的NO、NO2进入大气后会破坏臭氧层.可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下: NO2+NO+2NaOH═2NaNO2+H2O 2NO2+2NaOH═NaNO2+NaNO3+H2O,氨气也可以用来处理氮氧化物.例如,氨气与一氧化氮可发生如下反应:4NH3+6NO═5N2+6H2O,将一定量NO和NO2的混合气体通入300 mL 5mol/L NaOH溶液中,恰好被完全吸收。下列说法正确的是( )
A. 原混合气体中NO在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为2:1
C. 若用氨气处理,所需氨气的物质的量可能为1.6mol
D. 若用氨气处理,所需氨气在标准状况下的体积可能为17.92L
难度: 中等查看答案及解析
-
下列叙述中,不正确的是( )
A. 稳定性:HCl>H2S B. 碱性:KOH>NaOH
C. 氧化性:Na+>Al3+ D. 沸点:H2O>H2S
难度: 简单查看答案及解析
-
下列有关元素周期表的说法正确的是( )
A. IA族的元素全部是金属元素
B. 第一、二、三周期三个周期所含元素种类较少,称为短周期,只包括主族元素,不包括副族元素
C. 元素周期表是元素周期律的具体表现形式
D. 0族元素原子的最外层电子数均为8
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2
2NO
B. 检验久置 Na2SO3是否变质,可用BaCl2溶液和稀硝酸
C. SO2通入BaCl2溶液中会产生白色沉淀
D. 将铜片放入浓硫酸中,无明显现象是因为铜片发生了钝化
难度: 中等查看答案及解析
-
下列各组离子在酸性溶液中因发生氧化还原反应而不能大量共存的是( )
A. Ba2+、SO42-、NO3- B. Mg2+、OH—、SO42-
C. NH4+、Fe3+、CO32- D. Na+、Fe2+、NO3-
难度: 简单查看答案及解析
-
短周期元素M和N的简单离子M2+和N2-具有相同的电子层结构,则下列说法正确的是( )
A. M的原子序数比N小 B. M2+的离子半径比N2-小
C. M原子和N原子的电子层数相等 D. M原子和N原子最外层电子数相等
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价见下表:
元素代号
A
L
M
Q
R
T
原子半径/nm
0.183
0.160
0.143
0.102
0.111
0.074
主要化合价
+1
+2
+3
+6、-2
+2
-2
下列叙述正确的是( )
A. A、L、M三元素的金属性逐渐增强
B. 在RCl2分子中,各原子均满足8电子的稳定结构
C. Q元素的最高价氧化物为电解质,其水溶液能够导电
D. A在T单质中燃烧所形成的化合物中含有共价键和离子键
难度: 中等查看答案及解析
-
在水溶液中,YO3n-和S2-发生反应的离子方程式如下:YO3n- + 3S2- + 6H+ == Y- + 3S↓ + 3H2O。下列说法正确的是( )
A. 还原性:S2-<Y- B. n=3
C. Y原子的最外层电子数为5 D. HY的水溶液的酸性一定比H2S的水溶液的酸性强
难度: 中等查看答案及解析
-
为纪念编制了第一个元素周期表的俄国化学家门捷列夫,人们把第101号元素(人工合成元素)命名为钔。该元素最稳定的一种核素为
,该原子中子数为( )
A. 56 B. 101 C. 157 D. 258
难度: 简单查看答案及解析
-
除去下列物质中的杂质选用的试剂和方法最合理的是( )
选项
物质
杂质
试剂
方法
A
铜
氧化铜
稀硝酸
过滤
B
二氧化硫
氯化氢
饱和亚硫酸钠溶液
洗气
C
三氧化硫
二氧化硫
氧气
加热
D
二氧化硅
氧化铝
盐酸
过滤
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
硒(Se)是第4周期ⅥA族元素,下列叙述不正确的是( )
A. 硒的氢化物为H2Se B. 硒可以形成SeO2和SeO3
C. 硒是一种金属性很强的元素 D. 硒的最高价氧化物对应水化物的是H2SeO4
难度: 简单查看答案及解析
-
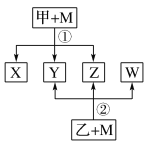
某单质有如右转化关系,该单质可能是( )

A. 氮气 B. 硅 C. 硫 D. 铁
难度: 简单查看答案及解析
-
部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所
示:
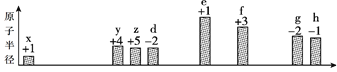
原子序数
下列说法不正确的是( )
A. x、z、d三种元素能形成具有强氧化性的酸
B. 根据g、h的单质与Fe反应的情况,可以判断h的非金属性大于g
C. 工业上通过电解f、h形成的化合物制取f 单质
D. x与其他元素可形成共价化合物或离子化合物
难度: 中等查看答案及解析