-
下列推论正确的是
A.S(g)+O2(g)=SO2(g)△H1,S(s)+O2(g)=SO2(g)△H2;△H1>△H2
B.C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol,则:由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=﹣57.4kJ/mol.则含20gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,则:该反应任何温度下都能自发进行
难度: 中等查看答案及解析
-
醋酸是电解质,下列事实能说明醋酸是弱电解质的组合是
①醋酸与水能以任意比互溶 ②醋酸溶液能导电
③醋酸溶液中存在醋酸分子 ④0.1 mol·L-1醋酸的pH比0.1 mol·L-1盐酸pH大
⑤醋酸能和碳酸钙反应放出CO2⑥0.1 mol·L-1醋酸钠溶液pH=8.9
⑦大小相同的锌粒与相同物质的量浓度的盐酸和醋酸反应,醋酸产生H2速率慢
A.②⑥⑦ B.③④⑤⑥ C.③④⑥⑦ D.①②
难度: 中等查看答案及解析
-
已知反应mX(g)+nY(g)
qZ(g)的△H<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A. 通入稀有气体使压强增大,平衡将正向移动
B. X的正反应速率是Y的逆反应速率的m/n倍
C. 降低温度,混合气体的平均相对分子质量变小
D. 若平衡时X、Y的转化率相等,说明反应开始时X、Y的物质的量之比为n:m
难度: 中等查看答案及解析
-
下列各溶液中,微粒的物质的量浓度关系正确的是
A. 10 mL 0.5 mol/L CH3COONa溶液与6 mL 1 mol/L盐酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+)
B. 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
C. 在NaHA溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
D. c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液和NH4Cl溶液:c[(NH4)2SO4]<c[(NH4)2CO3]<c(NH4Cl)
难度: 困难查看答案及解析
-
在密闭容器中通入A、B两种气体,在一定条件下反应: 2A(g)+B(g)
2C(g) △H<0,达到平衡后,改变一个条件,下列量(Y)的变化一定符合图中曲线的是( )

A.①③ B.②③④ C.①②③ D.②④
难度: 中等查看答案及解析
-
常温下,在下列溶液中,一定能大量共存的是 ( )
A.在
的溶液中:
、
、
、
B.水电离的
的溶液中:
、
、
、
C.能和Al反应产生氢气的溶液中:
、
、
、
D.在
的溶液中:
、
、
、
难度: 中等查看答案及解析
-
下列过程或现象与盐类水解无关的是( )
A.加热稀醋酸溶液其 pH稍有减小
B.纯碱溶液去油污
C.小苏打溶液与AlCl3溶液混合产生气体和沉淀
D.浓的硫化钠溶液有臭味
难度: 简单查看答案及解析
-
使18g焦炭发生不完全燃烧,所得气体中CO占1/3体积,CO2占2/3体积,已知:C(s)+1/2O2(g)=CO(g) ΔH= -Q1 kJ/mol;CO(g)+1/2O2(g)=CO2(g) ΔH= -Q2 kJ/mol。与这些焦炭完全燃烧相比较,损失的热量是( )
A.1/3Q1 kJ B.1/3Q2 kJ C.1/3(Q1+Q2) kJ D.1/2Q2 kJ
难度: 中等查看答案及解析
-
下列叙述中,正确的是( )
A.钢铁腐蚀的负极反应为:Fe - 3e- = Fe3+
B.Cu-Zn及H2SO4溶液构成的原电池中负极材料为Cu
C.无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分
D.H2-O2燃料电池中电解液为H2SO4,则正极反应式为:O2 + 4e- = 2O2-
难度: 中等查看答案及解析
-
在一定温度下,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图所示。则下列有关推断正确的是( )
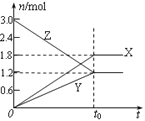
①该反应的化学方程式为:3X+2Y
2Z
②若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间大于t0
③若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态
④若达平衡后,对容器Ⅱ升高温度时其体积增大,说明Z发生的反应为吸热反应
A.①②③④ B.②③ C.③④ D.①②④
难度: 困难查看答案及解析
-
某温度下,在容积固定的密闭容器中发生可逆反应:A(g)+2B(g)
2Q(g)。平衡时,各物质的浓度比为c(A)∶c(B)∶c(Q)=1∶1∶2。保持温度不变,以1∶1∶2的体积比再充入A、B、Q,则下列叙述正确的是
A.刚充入时反应速率,v(正)减小,v(逆)增大
B.达到新的平衡时,反应混合物中A、B的物质的量分数增加
C.达到新的平衡时,c(A)∶c(B)∶c(Q)仍为1∶1∶2
D.达到新的平衡过程中,体系压强先增大,后逐渐减小
难度: 极难查看答案及解析
-
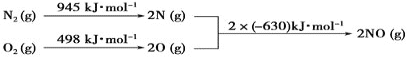
我国采用长征三号甲运载火箭成功发射了 “嫦娥一号” 卫星。肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,反应生成N2和水蒸气。已知:N2(g)+2O2(g)=N2O4(g) △H =+8.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= -534kJ/mol
下列表示肼和N2O4反应的热化学方程式,正确的是 ( )
A.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H=–1059.3 kJ/mo
B.N2H4(g) +
N2O4(g) =
N2(g) + 2H2O(g) △H=–542.7 kJ/mol
C.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–542.7 kJ/mol
D.2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(g) △H=–1076.7 kJ/mol
难度: 简单查看答案及解析
-
在相同温度和压强下,对反应CO2(g)+H2(g)
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表
CO2
H2
CO
H2O
甲
amol
amol
0mol
0mol
乙
2amol
amol
0mol
0mol
丙
0mol
0mol
amol
amol
丁
amol
0mol
amol
amol
上述四种情况达到平衡后,n(CO)的大小顺序是
A. 乙=丁>丙=甲 B. 乙>丁>甲>丙
C. 丁>乙>丙=甲 D. 丁>丙>乙>甲
难度: 中等查看答案及解析
-
镁燃料电池以镁合金作为电池的一极,向另一极充入H2O2,电解质溶液是酸化的NaCl溶液,放电时总反应式为Mg+2H++H2O2=Mg2++2H2O。下列关于该电池的说法中正确的是( )
A.放电时H+在正极反应得电子 B.正极反应式为H2O2 + 2e- = 2OH-
C.镁合金为电源负极,发生氧化反应 D.放电时正极的pH减小
难度: 中等查看答案及解析
-
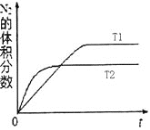
用来表示可逆反应:2A(g)+B(g)
2C(g)(逆反应吸热)的正确图象是下图中的( )

A.①③④ B.①②③④ C.①③ D.②④
难度: 中等查看答案及解析
-
有4种混合溶液,分别由等体积0.1mol/L的2种溶液混合面成:①CH3COONa与HCl ②CH3COONa与NaOH ③CH3COONa与NaCl ④CH3COONa与NaHCO3下列各项排序正确的是( )
A.pH:②>③>④>① B.c(CH3COO-):②>④>③>①
C.溶液中c(H+):①>③>②>④ D.c(CH3COOH):①>④>③>②
难度: 中等查看答案及解析