-
下列过程属于放热反应的是( )
A.用石灰石烧制石灰 B.在生石灰中加水
C.浓硫酸的稀释 D.硫酸铵与氢氧化钙的反应
难度: 简单查看答案及解析
-
1 mol H—H键的键能是436kJ,1 mol I—I键的键能是151kJ,1 mol H—I键的键能是299kJ,则对反应H2(g)+I2(g)
2HI(g)的说法,不正确的是 ( )
A.放热反应 B.吸热反应 C.化合反应 D.可逆反应
难度: 简单查看答案及解析
-
自由能的变化(ΔG)是反应方向判断的复合判据:ΔG=ΔH-TΔS,ΔG<0时,反应正向自发进行。已知某化学反应其ΔH=-122 kJ·mol-1,ΔS=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )。
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
难度: 简单查看答案及解析
-
下列事实不能用勒夏特列原理解释的是
A.打开汽水瓶时,有大量气泡溢出
B.在配制硫酸亚铁溶液时往往要加入一定量铁粉
C.氨水应密闭保存放置于低温处
D.实验室用排饱和食盐水的方法收集氯气
难度: 中等查看答案及解析
-
已知热化学方程式:
C(金刚石,s)+O2(g)===CO2(g) ΔH1
C(石墨,s)+O2(g)===CO2(g) ΔH2
C(石墨,s)===C(金刚石,s) ΔH3=+1.9 kJ·mol-1
下列说法正确的是( )
A.石墨转化成金刚石的反应是吸热反应
B.金刚石比石墨稳定
C.ΔH3=ΔH1-ΔH2
D.ΔH1>ΔH2
难度: 中等查看答案及解析
-
已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
难度: 中等查看答案及解析
-
关于原电池的叙述中正确的是( )
A.构成原电池的两极必须是两种不同金属
B.原电池是将化学能转化为电能的装置
C.原电池工作时总是负极溶解,正极上有物质析出
D.原电池的正极是还原剂,总是溶液中的阳离子在此被还原
难度: 简单查看答案及解析
-
关于钢铁腐蚀与防护的说法不正确的是( )
A.钢铁的吸氧腐蚀和析氢腐蚀的负极反应式均为Fe-2e-===Fe2+
B.钢铁发生吸氧腐蚀时,正极反应式为O2+2H2O+4e-===4OH-
C.地下钢管连接镁块是采用牺牲阳极保护法
D.用外加电流的阴极保护法防止钢铁腐蚀时,钢铁接电源的正极
难度: 简单查看答案及解析
-
对于可逆反应:C(s)+CO2(g)
2CO(g),在一定温度下其平衡常数为K。下列条件的变化中,能使K值发生变化的是
A.将C(s)的表面积增大 B.增大体系的压强
C.升高体系的温度 D.使用合适的催化剂
难度: 中等查看答案及解析
-
对于任何一个化学平衡体系,采取以下措施,一定会使平衡发生移动的是( )
A. 加入一种反应物 B. 增大体系的压强 C. 升高温度 D. 使用催化剂
难度: 中等查看答案及解析
-
以石墨为电极分别电解水和饱和食盐水,关于两个电解池反应的说法正确的是( )
A.阳极反应式相同
B.电解结束后所得液体的pH相同
C.阴极反应式相同
D.通过相同电量时生成的气体总体积相等(同温同压)
难度: 中等查看答案及解析
-
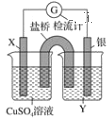
如图是一电池,下列有关说法正确的是
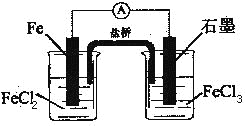
A.该电池负极反应为:2Fe2+-2e-
2Fe3+
B.当有6.02×1023电子转移时,Fe电极减少56g
C.石墨电极上发生氧化反应
D.盐桥中K+移向FeCl3溶液
难度: 中等查看答案及解析
-
现有A、B、C、D四种金属片:
①把A、B用导线连接后同时浸入稀硫酸中,B表面变黑并逐渐溶解;
②把C、D用导线连接后同时浸入稀硫酸中,C发生氧化反应;
③把A、C用导线连接后同时浸入稀硫酸中,电子流动方向为A→导线→C。
根据上述情况,下列说法中正确的是( )
A.在①中,金属片B发生还原反应
B.在②中,金属片C作正极
C.如果把B、D用导线连接后同时浸入稀硫酸中,则金属片D上有气泡产生
D.上述四种金属的活动性由强到弱的顺序是:A>B>C>D
难度: 中等查看答案及解析
-
如图所示的A、B两个电解池中的电极均为铂,在A池中加入0.05 mol·L−1的CuCl2溶液,B池中加入0.1 mol·L−1的AgNO3溶液,进行电解。a、b、c、d四个电极上所析出的物质的物质的量之比是
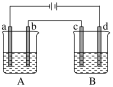
A.2∶2∶4∶1 B.1∶1∶2∶1
C.2∶1∶1∶1 D.2∶1∶2∶1
难度: 中等查看答案及解析
-
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是
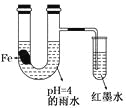
A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH-
D.U型管中溶液pH逐渐减小
难度: 中等查看答案及解析
-
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
难度: 中等查看答案及解析
-
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )

A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
难度: 简单查看答案及解析
-
有平衡体系CO(g)+2H2(g)====CH3OH(g) ΔH<0,为增加甲醇的产量,应采取的正确措施是( )
A.高温、高压 B.适宜的温度、高压、催化剂
C.低温、低压 D.高温、高压、催化剂
难度: 简单查看答案及解析
-
如图装置分别通电一段时间后,溶液的质量增加的是
A.
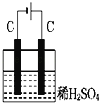 B.
B.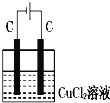 C.
C.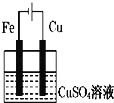 D.
D.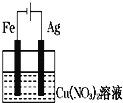
难度: 中等查看答案及解析
-
微型纽扣电池在现代生活中有广泛应用,有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,电极反应为Zn+2OH--2e-===ZnO+H2O,Ag2O+H2O+2e-===2Ag++2OH-。根据上述反应式,判断下列叙述中正确的是( )
A.在使用过程中,电池负极区溶液的pH增大
B.在使用过程中,电子由Ag2O经外电路流向Zn极
C.Zn是负极,Ag2O是正极
D.Zn极发生还原反应,Ag2O极发生氧化反应
难度: 中等查看答案及解析