-
下列对化学反应本质的认识,错误的是
A.原子一定重新组合 B.一定有电子转移
C.有旧键断裂和新键形成 D.必然伴随着能量的变化
难度: 中等查看答案及解析
-
化学式为N2H6SO4的某晶体,其晶体类型与硫酸铵相同,则N2H6SO4晶体中不存在
A.离子键 B.共价键 C.分子间作用力 D.阳离子
难度: 中等查看答案及解析
-
下列各组数据比较,前者比后者小的是
A.氯水与氨水中微粒种类 B.乙烷与苯分子中碳碳键键长
C.氯化铯与氯化钠的熔点 D.Al2O3与AlCl3的熔点
难度: 中等查看答案及解析
-
秸秆、稻草等生物质是一种污染小的可再生能源,其主要转化途径及主要产物如图。下列有关说法错误的是( )
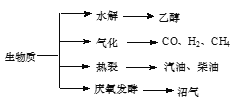
A.生物质能所含能量本质上来源于太阳能
B.由秸秆等物质水解获得的乙醇属生物质能
C.生物质裂解获得的汽油、柴油等属于纯净物
D.由秸杆稻草等发酵获得的沼气,主要成分是甲烷
难度: 简单查看答案及解析
-
在“石蜡→液体石蜡→石蜡蒸气→裂化气”的变化过程中,被破坏的作用力依次是
A.范德华力、范德华力、范德华力
B.范德华力、范德华力、共价键
C.范德华力、共价键、共价键
D.共价键、共价键、共价键
难度: 中等查看答案及解析
-
不能用于比较Na与Al金属性相对强弱的事实是
A.Na和AlCl3溶液反应 B.最高价氧化物对应水化物的碱性
C.单质与H2O反应的难易程度 D.同浓度NaCl和AlCl3溶液的pH
难度: 中等查看答案及解析
-
实验室制取下列物质的实验中未利用冷凝原理的是
A.乙酸乙酯 B.乙酸丁酯 C.溴乙烷 D.乙烯
难度: 中等查看答案及解析
-
已知X、Y、Z三种短周期元素在周期表中的位置如图所示,设X的原子序数为a。则下列说法正确的是
Y
X
Z
A.Y是非金属性最强的元素
B.Z是金属元素
C.Y的原子序数为a-7
D.X的气态氢化物化学式为H2X
难度: 中等查看答案及解析
-
常温下加入下列物质,能使溶液中c(CO32-)、c(HCO3-)均降低,而pH增大的是
A.氢氧化钠溶液 B.通入二氧化碳 C.氢氧化钙溶液 D.盐酸
难度: 中等查看答案及解析
-
下列说法正确的是
A.分子晶体中一定存在分子间作用力,不一定存在共价键
B.分子中含两个氢原子的酸一定是二元酸
C.含有金属阳离子的晶体一定是离子晶体
D.元素的非金属性越强,其单质的活泼性一定越强
难度: 中等查看答案及解析
-
在海轮的船壳上连接锌块,下列相关说法正确的是
A.制成合金保护船体 B.是外加电流的阴极保护法
C.船体的反应:Fe -2e—=Fe2+ D.锌块的反应:Zn -2e—=Zn2+
难度: 中等查看答案及解析
-
在25℃时,有80g饱和Ba(OH)2溶液,向其中加入纯BaO粉末ag,反应后温度恢复到25℃,下列有关该溶液的说法正确的是( )
A.溶液中c(Ba2+)将增大 B.溶液的pH将增大
C.溶液中Ba2+的物质的量将减少 D.溶液中c(OH-)减少
难度: 困难查看答案及解析
-
常温下0.1 mol/L醋酸溶液的pH = a,下列能使溶液pH =(a +1)的措施是
A.将溶液稀释到原体积的10倍
B.加入适量的醋酸钠固体
C.加入等体积0.1 mol/L烧碱溶液
D.加入等体积0.1 mol/L盐酸
难度: 中等查看答案及解析
-
25 ℃时,水的电离达到平衡:H2O
H++ OH-;ΔH > 0 ,下列叙述正确的是
A.向水中加人稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变
C.向水中加人少量固体CH3COONa ,平衡逆向移动,c(H+)降低
D.将水加热,Kw增大,pH不变
难度: 中等查看答案及解析
-
观察如图装置,下列说法正确的是

A.a、b接电流表,该装置为原电池
B.a、b接直流电源,该装置为电解池
C.a、b接直流电源,铁可能不易被腐蚀
D.a、b接电流表或接直流电源,铁都可能是负极
难度: 中等查看答案及解析
-
有机物M的结构如图所示。关于M的描述正确的是

A.分子式为C8H6O6
B.能发生中和、取代、消去、氧化、加成反应
C.1 molM与溴水发生反应的产物可能有3种
D.1molM与足量氢氧化钠溶液反应,消耗4molNaOH
难度: 中等查看答案及解析
-
由右表提供数据及相关物质结构知识,反应:SiCl4(g)+2H2(g)→Si(s)+4HCl(g),生成1mol
晶体硅的热效应是
化学键
Si-Cl
H-H
Si-Si
H-Cl
键能(kJ/mol)
360
436
176
431
A.吸收236kJ B.放出236kJ C.放出116kJ D.吸收116kJ
难度: 中等查看答案及解析
-
某溶液中含有下列离子中的五种:Ba2+、Fe2+、Al3+、Fe3+、Mg2+、HCO3–、CO32–、Cl–、NO3–、SO42–,浓度均为0.1mol/L。向其中加入足量的盐酸,有气体生成且反应后溶液中阴离子的种类没有变化。以下分析错误的是
A.原溶液中不含HCO3–和CO32– B.向加盐酸后的溶液中再加KSCN溶液,显红色
C.能确定原溶液中的五种离子 D.原溶液中有三种阳离子和两种阴离子
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是
A.次氯酸钙中通入过量二氧化碳:Ca2++2C1O-+H2O+CO2=CaCO3↓+2HClO
B.硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+=Fe3+ +4H2O
C.用氨水吸收少量二氧化硫:NH3·H2O+SO2=NH4++HSO3-
D.硝酸铁溶液中加过量氨水:Fe3++3NH3·H2O= Fe(OH)3↓+3NH4+
难度: 困难查看答案及解析
-
常温下已知两种一元弱酸HX和HY,如果向NaX溶液中通CO2气体,只能生成HX和NaHCO3;往NaY溶液中通入CO2则生成HY和Na2CO3。有关叙述正确的是
A.三种酸的电离常数:Ki1(H2CO3) > Ki(HX) > Ki(HY) > Ki2(H2CO3)
B.NaX溶液中通入足量CO2后的离子浓度:c(HCO3-)>c(CO32-)>c(X-)
C.同浓度溶液的碱性:NaX > Na2CO3 > NaY > NaHCO3
D.结合H+的能力:Y- > CO32- > X- > HCO3-
难度: 困难查看答案及解析