-
下列关于热化学反应的描述中正确的是( )
A.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
B.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热难度: 中等查看答案及解析
-
丙烯酸(CH2=CH-COOH)的性质可能有( )
①加成反应 ②取代反应 ③酯化反应 ④中和反应 ⑤氧化反应.
A.只有①③
B.只有①③④
C.只有①③④⑤
D.①②③④⑤难度: 中等查看答案及解析
-
下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀H2SO4反应
B.Ba(OH)2•8H2O与NH4Cl反应
C.灼热的炭与CO2反应
D.甲烷在O2中的燃烧反应难度: 中等查看答案及解析
-
以节能减排为基础的低碳经济是保持社会可持续发展的战略举措.下列做法违背发展低碳经济的是( )
A.发展氢能和太阳能
B.限制塑料制品的使用
C.提高原子利用率,发展绿色化学
D.尽量用纯液态有机物代替水作溶剂难度: 中等查看答案及解析
-
X、Y、Z、W四块金属分别用导线两两相连浸入稀硫酸中组成原电池.X、Y相连时,X为负极;Z、W相连时,电流方向是W→Z;X、Z相连时,Z极上产生大量气泡;W、Y相连时,W极发生氧化反应.据此判断四种金属的活动性顺序是( )
A.X>Z>W>Y
B.Z>X>Y>W
C.X>Y>Z>W
D.Y>W>Z>X难度: 中等查看答案及解析
-
在理论上可用于设计原电池的化学反应是( )
A.2Al(s)十2NaOH(aq)+2H2O(1)=2NaAlO2(aq)+3H2(g);△H<0
B.Ba(OH)2•8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3•H2O(aq)+8H2O(1);△H>0
C.CaC2(s)+2H2O(1)→Ca(OH)2(s)+C2H2(g);△H<0
D.FeCl3(aq)十3H2O(1)⇌Fe(OH)3(s)+3HCl(aq);△H>0难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,且已知C2H2(g)+5/2O2(g)=2CO2(g)+H2O(l)△H=-1300kJ•mol-1,则下列说法正确的是( )
A.当有20NA个电子转移时,放出2600kJ 热量
B.当有2NA个碳氧双键形成时,放出1300kJ热量
C.若生成NA个水蒸气分子焓变为△H1,则△H1<△H
D.上述反应为吸热反应难度: 中等查看答案及解析
-
充分燃烧一定量的丁烷放出的热量为Q,恰好完全吸收生成的CO2生成正盐需要消耗2.5mol/L KOH溶液100mL,则燃烧1mol丁烷放出的热量为( )
A.4Q
B.10Q
C.16Q
D.32Q难度: 中等查看答案及解析
-
锌锰电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电路中每通过0.2mol电子,锌的质量理论上减小6.5g
B.电池负极的电极反应式为Zn-2e-+2 OH-=Zn(OH)2
C.电池工作时,电流由正极通过外电路流向负极
D.碱性锌锰电池是二次电池难度: 中等查看答案及解析
-
某学习小组为研究电化学原理,设计如图装置.下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C.a和b分别连接足够电压的直流电源正、负极时,Cu2+向铜电极移动
D.无论a和b是否用导线连接,铁片均溶解,溶液从蓝色逐渐变成浅绿色难度: 中等查看答案及解析
-
下列事实不能用电化学理论解释的是( )
A.轮船水线以下的船壳上装一定数量的锌块
B.铝片不用特殊方法保存
C.纯锌与稀硫酸反应时,滴入少量硫酸铜溶液后速率加快
D.镀锌的铁比镀锡的铁耐用难度: 中等查看答案及解析
-
一种新型燃料电池,一极通入乙烷,另一极通入氧气,电解质是KOH溶液,下列对此电池的说法正确的是( )
A.正极反应为C2H6+18OH--14e-═2CO32-+12H2O
B.放电一段时间后,正极周围的pH降低
C.每消耗1mol C2H6,电池中就消耗4mol KOH
D.电池的总反应是2C2H6+5O2═2CO2+6H2O难度: 中等查看答案及解析
-
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质.下列说法不正确的是( )
A.淀粉和纤维素属于高分子化合物,均可用(C6H10O5)n表示,它们互为同分异构体
B.淀粉水解的最终产物与新制的Cu(OH)2反应
C.蛋白质溶液中加入饱和硫酸铵溶液后产生的沉淀能重新溶于水
D.当人误食重金属盐类时,可以喝大量的牛奶、蛋清解毒难度: 中等查看答案及解析
-
下列各组热化学方程式中,化学反应的△H前者大于后者的是( )
①C(s)+O2(g)═CO2(g);△H1 C(s)+O2(g)═CO(g);△H2
②S(s)+O2(g)═SO2(g);△H3 S(g)+O2(g)═SO2(g);△H4
③H2(g)+O2(g)═H2O(l);△H5 2H2(g)+O2(g)═2H2O(l);△H6
④CaCO3(s)═CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)═Ca(OH)2(s);△H8.
A.①
B.④
C.②③④
D.①②③难度: 中等查看答案及解析
-
用惰性电极电解下列溶液一段时间后,再加入一定质量的另一物质(中括号内),所得溶液能与原来溶液完全一样的是( )
A.CuCl2[CuSO4]
B.AgNO3[Ag2O]
C.NaCl[Cl2]
D.CuSO4[Cu(OH)2]难度: 中等查看答案及解析
-
白磷与氧可发生如下反应:P4+5O2═P4O10.已知断裂下列化学键需要吸收的能量分别为:P-P:a kJ•mol-1、P-O:b kJ•mol-1、P=O:c kJ•mol-1、O=O:d kJ•mol-1.根据图示的分子结构和有关数据估算该反应的△H,其中正确的是( )
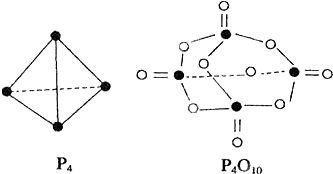
A.(6a+5d-4c-12b)kJ•mol-1
B.(4c+12b-6a-5d)kJ•mol-1
C.(4c+12b-4a-5d)kJ•mol-1
D.(4a+5d-4c-12b)kJ•mol-1难度: 中等查看答案及解析
-
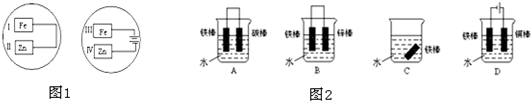
如图是化学能与电能相互转换的两套装置,对此两套装置的分析正确的是( )

A.两装置中,铁电极上均有较大量气体产生
B.图2装置中铁片上发生氧化反应
C.石墨电极上发生的电极反应均为:2H++2e-=H2↑
D.随着反应的进行,图1中溶液的pH增大,图2中溶液的pH减小难度: 中等查看答案及解析
-
如图所示,a、b、c均为石墨电极,d为碳钢电极,通电进行电解.假设在电解过程中产生的气体全部逸出,下列说法正确的是( )

A.若向甲烧杯中滴加紫色的石蕊试液,通电一段时间后,溶液会变红
B.乙烧杯中的d电极反应式为Fe-3e-=Fe3+
C.当电解一段时间后,将甲、乙两溶液混合,一定会有沉淀生成
D.当b极增重5.4g时,d极产生的气体为2.24L(标准状况)难度: 中等查看答案及解析