-
生活离不开化学。某种金属制成的器皿,放置于空气中,其表面会逐渐变黑,如将表面变黑的上述器皿放入盛有食盐水的铝制容器中浸泡,一段时间后,黑色完全褪去。下列成语与该金属有关的是( )
A. 衣紫腰银 B. 点石成金 C. 铜鸵荆棘 D. 铁柞成针
难度: 中等查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A. 加催化剂有利于氨的催化氧化反应
B. 实验室用排饱和食盐水的方法收集氯气
C. 500℃左右比室温更有利于合成氨的反应
D. 压缩H2(g)、I2(g)、HI(g)平衡体系,体系颜色加深
难度: 简单查看答案及解析
-
五种短周期元素X、Y、Z、W、Q原子序数依次增大,W元素在短周期元素中原子半径最大,X、W同族,Z、Q同族,X、Y两种元素的最高正价和最低负价代数和均为0,由上述五种元素中的某几种元素组成的两种化合物均可在一定条件下洗涤含硫的试管,以下说法正确的是( )
A.酸性:H2YO3<H2QO3,所以非金属性Y<Q
B.X与W形成的化合物中各原子均满足最外层8电子稳定结构
C.X与Y形成的化合物只含有共价键
D.由Z、W、Q三种元素形成的盐只有两种
难度: 困难查看答案及解析
-
下列说法不正确的是( )
A.已知冰的熔化热为6.0 kJ • mol-1,冰中氢键键能为20 kJ • mol-1,假设1 mol 冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15 %的氢键
B.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, 电离常数
。若加水稀释,则CH3COOH
CH3COO-+H+向右移动,a增大, Ka不变
C.甲烷的标准燃烧热为-890.3 kJ• mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3 kJ • mol-1
D.500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为:N2(g)+3H2(g)
2NH3(g)△H=-38.6kJ/mol
难度: 中等查看答案及解析
-
常温下0.1mol/L①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是( )
A.①中[CH3COOH]>[CH3COO-]>[H+]>[OH-]
B.①②等体积混合后,醋酸根离子浓度小于③的二分之一
C.①③等体积混合以后,溶液呈酸性,则(Na+)>(CH3COO-)>(H+)
D.①②等体积混合以后,水的电离程度比①③等体积混合的电离程度小
难度: 中等查看答案及解析
-
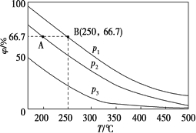
某温度下,
和
的电离常数分别为
和
。将
和体积均相同的两种酸溶液分别稀释,其
随加水体积的变化如图所示。下列叙述正确的是( )
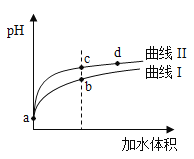
A. 曲线Ⅰ代表
溶液
B. 溶液中水的电离程度:b点>c点
C. 从c点到d点,溶液中
保持不变(其中
、
分别代表相应的酸和酸根离子)
D. 相同体积a点的两溶液分别与
恰好中和后,溶液中
相同
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.澄清透明的溶液中:Al3+、Cu2+、SO42-、Cl-
B.中性溶液中:Al3+、NH4+、Cl-、S2-
C.c(OH-)<
的溶液中:Na+、Ca2+、ClO-、NO3-
D.在由水电离出的c(H+)=10-13mol·L-1的溶液中:NH4+、AlO2-、SO42-、NO3-
难度: 中等查看答案及解析
-
已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。
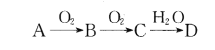
下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
难度: 困难查看答案及解析
-
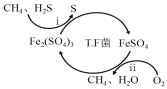
某柔性屏手机的柔性电池以碳纳米管做电极材料,以吸收ZnSO4溶液的有机高聚物做固态电解质,其电池总反应为:MnO2+
Zn+(1+
) H2O+
ZnSO4
MnOOH+
ZnSO4[Zn(OH)2]3·xH2O,其电池结构如图1所示,图2是有机高聚物的结构片段。
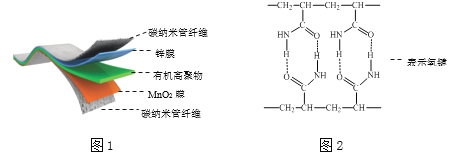
下列说法中,不正确的是( )
A.碳纳米管具有导电性,可用作电极材料
B.合成有机高聚物的单体是:
C.充电时,Zn2+移向Zn膜
D.放电时,电池的正极反应为:MnO2 + e− + H+ = MnOOH
难度: 困难查看答案及解析
-
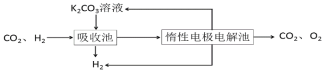
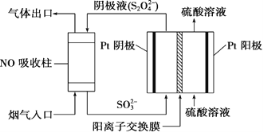
ZulemaBorjas等设计的一种微生物脱盐池的装置如图所示,下列说法正确的是( )
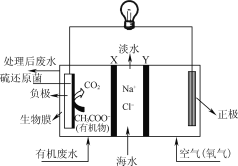
A. 该装置可以在高温下工作
B. X、Y依次为阳离子、阴离子选择性交换膜
C. 负极反应为CH3COO-+2H2O-8e-=2CO2↑+7H+
D. 该装置工作时,电能转化为化学能
难度: 中等查看答案及解析
-
一定条件下存在反应:2SO2(g)+O2(g)
2SO3(g),△H<0。现有三个体积相同的密闭容器I、II、III,按下图所示投料,并在400℃条件下开始反应。达到平衡时,下列说法正确的是 ( )

A.容器I、III中平衡常数相同
B.容器II、III中正反应速率相同
C.
的体积分数:
D.容器I和容器II中
的体积分数相同
难度: 困难查看答案及解析
-
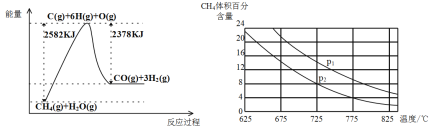
乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
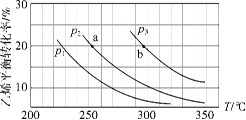
A.乙烯气相直接水合反应的∆H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =
D.达到平衡状态a、b所需要的时间:a>b
难度: 中等查看答案及解析
-
Y形管是一种特殊的仪器,与其他仪器组合可以进行某些实验探究。利用如图装置可以探究SO2与BaCl2反应生成BaSO3沉淀的条件。下列判断正确的是
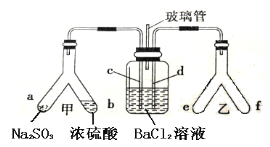
A.e、f两管中的试剂可以分别是浓氨水和NaOH固体
B.玻璃管的作用是连通大气,使空气中的氧气进入广口瓶,参与反应
C.c、d两根导管都必须插入BaCl2溶液中,保证气体与Ba2+充分接触
D.Y形管乙中产生的为氧化性气体,将BaSO3氧化为BaSO4沉淀
难度: 中等查看答案及解析
-
已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A.
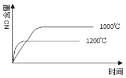
B.
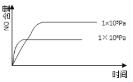
C.
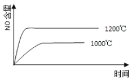
D.
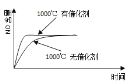
难度: 中等查看答案及解析
-
x、y、z、w是原子序数依次增大的短周期元素,由这四种元素组成的一种化合物a在加热时完全分解为三种产物,其中一种产物b是能使品红溶液褪色的气体,另一种产物c是能使湿润红色石蕊试纸变蓝的气体。下列说法正确的是( )
A.简单离子半径: x<y<z<w
B.y的简单氢化物的热稳定性比z的强
C.a、b、c中均含有极性共价健: a属于电解质,b和c都属于 非电解质
D.x、y、z 三种元素形成的化合物一定会抑制水的电离
难度: 中等查看答案及解析
-
向甲、乙、丙三个恒容密闭容器中分别充入一定量的A和B,发生反应:A(g)+xB(g)
2C(g)。
相关数据如下表,反应过程中C的浓度随时间变化关系如下图。下列说法正确的是
容器
甲
乙
丙
容积
0.5L
0.5L
1.0L
温度/℃
T1
T2
T2
反应物
起始量
1.5 mol A
0.5 mol B
1.5 mol A
0. 5 mol B
6 mol A
2 mol B
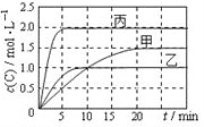
A.T1>T2,x=1
B.T2℃时,该反应的平衡常数为0. 8
C.A的平衡转化率a(甲):a(乙)=2:3
D.15~20min内C的平均反应速率v(乙)< v(丙)
难度: 困难查看答案及解析