-
下列有关性质的比较,不能用元素周期律解释的是( )
A. 酸性:H2SO4>H3PO4
B. 非金属性:Cl>Br
C. 碱性:NaOH>Mg(OH)2
D. 热稳定性:Na2CO3>NaHCO3
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是( )
A. 可溶于水 B. 有较高的熔点
C. 水溶液能导电 D. 熔融状态能导电
难度: 中等查看答案及解析
-
1869年,俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学史上的重要里程碑之一。下列有关元素周期表的说法正确的是( )
A. 元素周期表含元素最多的族是第ⅢB族 B. 元素周期表有18个族
C. 第ⅠA族的元素全部是金属元素 D. 短周期是第一、二、三、四周期
难度: 中等查看答案及解析
-
对于元素周期表,下列叙述中不正确的是
A. 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素
B. 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀材料的元素
C. 在金属元素区域可以寻找制备新型农药材料的元素
D. 元素周期表中位置靠近的元素性质相近
难度: 简单查看答案及解析
-
某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是( )
A. 14 B. 15 C. 16 D. 17
难度: 简单查看答案及解析
-
某粒子用
表示,下列关于该粒子的叙述中不正确的是( )
A. 所含中子数=A-Z B. 所含质子数=A-n
C. 所含电子数=Z+n D. 所带电荷数=n
难度: 简单查看答案及解析
-
已知某原子的结构示意图为
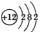 ,下列说法正确的是( )
,下列说法正确的是( )A. 该元素位于第2周期第ⅡA族 B. 该元素位于第2周期第0族
C. 该元素位于第3周期第ⅡA族 D. 该元素位于第3周期0族
难度: 简单查看答案及解析
-
关于卤素(用X表示)的下列叙述正确的是( )
A. 它们的离子半径随着核电荷数的增加而减小
B. HX都极易溶于水,它们的热稳定性随核电荷数增加而增强
C. 卤素单质的颜色从F2→I2按相对分子质量增大而加深
D. 从F→I其氢化物的沸点依次增大
难度: 简单查看答案及解析
-
下列对碱金属的叙述,其中完全不正确的组合是( )
①钾通常保存在煤油中,以隔绝与空气的接触
②碱金属常温下呈固态,取用时可直接用手拿
③碱金属中还原性最强的是钾
④碱金属的原子半径和离子半径都随核电荷数的增大而增大
A. ②③ B. ②④ C. ①④ D. ①③
难度: 简单查看答案及解析
-
有a、b、c、d四种元素,an+、bm+与cp-、dq-具有相同的电子层结构,且满足条件:n<m,p>q,则它们的离子半径的关系是
A. a>b>c>d B. c>d>a>b
C. c>a>d>b D. b>a>d>c
难度: 简单查看答案及解析
-
某短周期主族元素的原子A,核外共有n个电子层(n>2),则(n-1)层所能容纳的电子数为( )
A. 8个 B. 18个 C. 32个 D. 2个
难度: 简单查看答案及解析
-
W、X、Y、Z 4种短周期元素在元素周期表中的位置如图,其中Z位于ⅦA族。下列判断错误的是( )
W
Y
X
Z
A. W、Y可形成两种不同的化合物
B. Z的阴离子电子层结构与氩原子的相同
C. Y元素的非金属性比X元素的非金属性强
D. W的氢化物的沸点比Y的氢化物的沸点高
难度: 简单查看答案及解析
-
几种短周期元素的原子半径及主要化合价如表所示:
元素符号
X
Y
Z
R
T
原子半径
0.160
0.089
0.102
0.143
0.074
主要化合价
+2
+2
-2,+4,+6
+3
-2
根据表中信息,判断以下说法正确的是( )
A. 单质与稀硫酸反应的速率快慢:X<Y B. 离子半径:T2->X2+
C. 元素最高价氧化物对应水化物的碱性:R>X D. Z的氢化物比T的氢化物稳定
难度: 简单查看答案及解析
-
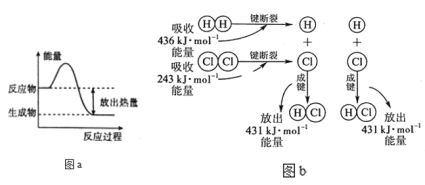
下列说法正确的是( )
A. 需要加热才能发生的反应一定是吸热反应
B. 放热的反应在常温下一定很容易发生
C. 放热反应还是吸热反应主要由反应物、生成物所具有的总能量的相对大小决定
D. 吸热反应发生过程中要不断从外界获得能量,放热反应自始至终不需要外界提供能量
难度: 简单查看答案及解析
-
下列反应属于吸热反应的是( )
①二氧化碳与赤热的炭反应生成一氧化碳
②葡萄糖在人体内氧化分解
③锌粒与稀H2SO4反应制取H2
④Ba(OH)2·8H2O固体与NH4Cl固体反应
A. ②④ B. ①② C. ①③ D. ①④
难度: 简单查看答案及解析
-
已知:物质的能量越低越稳定,白磷转化为红磷是放热反应,下列说法中正确的是( )
A. 白磷转化为红磷是物理变化
B. 红磷和白磷互为同素异形体
C. 相同条件下,红磷所具有的总能量比白磷的高
D. 在相同条件下白磷比红磷稳定
难度: 简单查看答案及解析
-
下列关于原电池的说法中,错误的是( )
A. 原电池是一种将化学能直接转化为电能的装置 B. 原电池中,正极发生氧化反应
C. 原电池的电子从负极经导线流向正极 D. 原电池的负极材料一般比正极活泼
难度: 简单查看答案及解析
-
下列装置中,能构成原电池的是( )
A.
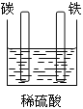 B.
B. 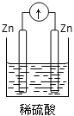 C.
C. 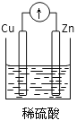 D.
D. 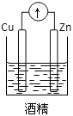
难度: 简单查看答案及解析
-
如图,在盛有稀硫酸的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,下列关于该装置的说法正确的是
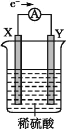
A. 外电路的电流方向为X→外电路→Y
B. 若两电极分别为Fe和石墨棒,则X为石墨棒,Y为Fe
C. X极上发生的是还原反应,Y极上发生的是氧化反应
D. 若两电极材料都是金属,则它们的活动性顺序为X>Y
难度: 中等查看答案及解析
-
如图装置中,M棒变细,N棒变粗。由此判断下表所列M、N、R物质,其中合理的是( )
选项
M
N
R
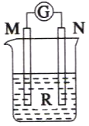
A
锌
铜
稀硫酸
B
铜
铁
稀盐酸
C
铁
铜
硝酸银
D
铜
铁
蔗糖溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析