-
在元素周期表中,同周期元素原子具有相同的( )
A. 电子层数 B. 核电荷数 C. 核外电子数 D. 最外层电子数
难度: 简单查看答案及解析
-
下列物质中含有非极性键的化合物是
A、NaOH B、Na2O2 C、Cl2 D、CO2
难度: 简单查看答案及解析
-
下列各组气态氢化物的稳定性按由强到弱的顺序排列的是
A. HI HCl H2S PH3
B. PH3 H2S HCl HBr
C. HF HCl H2S SiH4
D. NH3 PH3 H2S HCl
难度: 中等查看答案及解析
-
X+和Y2-具有与氩原子相同的电子层结构,下列叙述正确的是
A. X的原子序数比Y的小 B. X原子的最外层电子数比Y的大
C. X和Y原子的电子层数相等 D. X的原子半径比Y的大
难度: 简单查看答案及解析
-
下列各组的电极材料和电解液,不能组成原电池的是( )
A. 铜片、石墨棒,蔗糖溶液 B. 锌片、石墨棒,硫酸铜溶液
C. 锌片、铜片,稀盐酸 D. 铜片、银片,硝酸银溶液
难度: 简单查看答案及解析
-
造地球卫星用的一种高能电池——银锌电池,该电池的电极反应式为:Zn+2OH- -2e-= ZnO+H2O;Ag2O+H2O+2e-=2Ag+2OH-,据此判断氧化银是
A. 负极,并被氧化 B. 正极,并被还原
C. 负极,并被还原 D. 正极,并被氧化
难度: 简单查看答案及解析
-
10 mL 1mol/L的盐酸与一小块大理石的化学反应CaCO3+2HCl=CaCl2+CO2↑+H2O,下列措施能使化学反应速率提高的是( )。
A. 加入一定量的CaCl2 B. 加入5 mL 1.5 mol/L的盐酸
C. 加入15 mL 0.5 mol/L的盐酸 D. 加入5 mL H2O
难度: 中等查看答案及解析
-
把a、b、c、d四种金属片浸泡在稀硫酸中,用导线两两相连可以组成不同的原电池,a、b相连时,a为负极,c、d相连电流由d到c,a、c相连c为正极,b、d相连b上有大量气泡产生,则这四种金属活泼性由强到弱的序列为( )
A. abcd B. acdb C. cabd D. bdca
难度: 中等查看答案及解析
-
下列说法中,正确的是 ( )
A.离子化合物中一定不含共价键
B.共价化合物中一定不含离子键
C.两种元素组成的化合物中一定只含有一种化学健
D.由于水分子之间存在氢键,所以水分子比较稳定
难度: 中等查看答案及解析
-
下列电子式书写错误的是( )
A.
B.
C.
D. [
]2-
难度: 简单查看答案及解析
-
下列各组物质的性质顺序,不正确的是( )
A. 原子半径:Na<Mg<Al B. 热稳定性:HCl>HBr>HI
C. 酸性强弱:H2SiO3<H2CO3<H2SO4 D. 熔点:SiO2>NaCl>CO2
难度: 简单查看答案及解析
-
下列说法不正确的是( )
A. 温度升高,正逆反应速率都增大
B. 化学反应的速率和限度均可通过改变化学反应条件而改变
C. 可逆反应只是代表少数反应
D. 化学反应达到平衡状态时,正反应速率与逆反应速率相等
难度: 简单查看答案及解析
-
下列变化的比较, 不正确的是
A. 酸性强弱: HClO4> H2SO4> H3PO4> H4SiO4
B. 原子半径大小: Na > S > O
C. 碱性强弱: KOH > NaOH > LiOH
D. 还原性强弱: F-> Cl-> I-
难度: 中等查看答案及解析
-
某元素最高正价氧化物对应的水化物的化学式是H2XO4,这种元素的气态氢化物的化学式为( )
A. HX B. H2X C. XH3 D. XH4
难度: 简单查看答案及解析
-
哈伯因发明了用氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使上述反应发生N2+3H2
2NH3。下列说法正确的是
A. 达到化学平衡时,N2完全转化为NH3
B. 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C. 达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D. 达到化学平衡时,正反应和逆反应速率都为零
难度: 简单查看答案及解析
-
下列说法不正确的是( )。
A. 原电池负极被氧化
B. 任何化学反应都能设计成原电池
C. 化学反应的速率和限度均可通过改变化学反应条件而改变
D. 化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
难度: 简单查看答案及解析
-
下列各组微粒具有相同质子数和电子数的是( )
A. OH-和NH4+ B. H2O和NH3 C. F和OH- D. O2-和NH4+
难度: 简单查看答案及解析
-
元素的性质随原子序数的递增呈周期性变化的原因是( )
A. 元素原子的核外电子排布呈周期性变化 B. 元素原子的电子层数呈周期性变化
C. 元素的化合价呈周期性变化 D. 元素原子半径呈周期性变化
难度: 中等查看答案及解析
-
燃烧0.1mol两种气态烃的混合物,生成3.584LCO2(标况),和3.6克H2O,则混合气体中( )
A. 一定有甲烷 B. 一定有乙烷
C. 一定无甲烷 D. 一定有丙烷
难度: 中等查看答案及解析
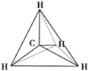 B.
B.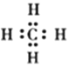 C.
C. D.
D.