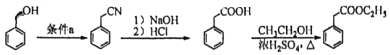
-
中国传统文化中包括许多科技知识。下列古语中不涉及化学变化的是( )
A.熬胆矾(CuSO4·5H2O)铁釜,久之亦化为铜 B.千淘万漉虽辛苦,吹尽狂沙始到金
C.凡石灰(CaCO3)经火焚炼为用 D.丹砂(HgS)烧之成水银,积变又成丹砂
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.二氧化硅的分子式为:SiO2 B.原子核内有8个中子的氧原子:
C.Be2+中的质子数和电子数之比为2:1 D.NH4Cl的电子式:
难度: 中等查看答案及解析
-
垃圾分类,指按一定规定或标准将垃圾分类储存、投放和搬运,从而转变成公共资源的一系列活动的总称。目前主要分为可回收垃圾、厨余垃圾(湿垃圾)、有害垃圾、其它垃圾(干垃圾)。下列垃圾归类不合理的是( )
A
B
C
D
垃圾
废易拉罐
废塑料瓶
废旧电池
剩饭剩菜
垃圾分类
可回收物
干垃圾
有害垃圾

A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组中的两种物质相互反应时,无论哪种过量,都可以用同一个离子方程式表示的是( )
①碳酸钠溶液与盐酸 ②偏铝酸钠溶液与盐酸 ③二氧化碳与氢氧化钠溶液 ④硝酸银溶液和氨水 ⑤氯化铝与氨水 ⑥碳酸氢钠溶液与澄清石灰水
A.③⑤ B.①③⑥ C.仅有⑤ D.②④
难度: 中等查看答案及解析
-
下列实验操作及现象能够达成相应实验目的的是( )
实验目的
实验操作及现象
A
证明酸性条件下H2O2氧化性强于I2
向淀粉KI溶液中滴入3滴稀硫酸,未见溶液变蓝;再加入10%的H2O2溶液,溶液立即变蓝色
B
证明SO2具有漂白性
将SO2通入酸性KMnO4 溶液中,溶液紫色褪去
C
证明碳的非金属性强于硅
将浓盐酸滴入碳酸钠固体中,生成的气体通入盛有水玻璃的试管中,出现浑浊
D
检验Na2SO3溶液是否变质
向Na2SO3溶液中加入Ba(NO3)2溶液,出现白色沉淀,再加入稀硝酸,沉淀不溶解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
如图是元素周期表中短周期的一部分,若A原子最外层的电子数比次外层少3,则下列说法正确的是( )
A.只有A的单质存在同素异形体
B.D的最高正价比A大
C.A、B、C的最高价氧化物对应水化物的酸性强弱的关系是C<B<A
D.离子半径的大小顺序是A>B>C>D
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数,下列说法正确的是( )
A.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.2.3gNa与氧气完全反应,反应中转移的电子数介于0.1NA到0.2NA之间
C.用惰性电极电解饱和食盐水,若线路中通过NA 个电子,则阴极产生11.2L (标况)气体
D.已知N2(g)+3H2(g)
2NH3(g) ΔH=-92kJ·mol-1,现有0.1molN2与0.3molH2混合反应,可放热9.2kJ
难度: 中等查看答案及解析
-
实验室为监测空气中汞蒸气的含量,往往悬挂涂有CuI的滤纸,根据滤纸是否变色或颜色发生变化所用去的时间来判断空气中的含汞量,其反应为4CuI+Hg===Cu2HgI4+2Cu。下列说法中正确的是( )
A.氧化剂与还原剂的物质的量之比是4∶1
B.当有2 mol CuI参与反应时,转移电子为1 mol
C.该反应的氧化产物为Cu
D.由Cu2+与I-直接反应制得CuI的离子方程式为Cu2++I-===CuI
难度: 中等查看答案及解析
-
下列书写正确的是( )
A.在酸性碘化钾溶液中滴加双氧水:2I-+2H++H2O2===I2+2H2O
B.向NaHSO4溶液中滴加Ba(OH)2溶液至溶液呈中性:H++SO42-+Ba2++OH-===BaSO4↓+H2O
C.氢硫酸电离:H2S
2H+ + S2-
D.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+===SO2↑+H2O
难度: 中等查看答案及解析
-
常温下,下列各组离子一定能在指定溶液中大量共存的是( )
A.加铁氰化钾产生蓝色沉淀的溶液中:Na+、Al3+、SO42-、ClO-
B.0.1mol/L的烧碱溶液中:K+、Ba2+、Cl-、HCO3-
C.
=1×10-13 mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
D.水电离的c(H+)=1×10-13 mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
难度: 中等查看答案及解析
-
在给定条件下,下列选项中所示的物质间转化均能一步实现的是( )
A.Fe
FeCl2
Fe(OH)2 B.S
SO3
H2SO4
C.N2
NO2
HNO3 D.CaCl2(aq)
CaCO3
CaSiO3
难度: 中等查看答案及解析
-
多硫化钠Na2Sx(
)在结构上与Na2O2、FeS2等有相似之处,Na2Sx在碱性溶液中可被NaClO氧化成Na2SO4,而NaClO被还原成NaCl,反应中Na2Sx与NaClO物质的量之比为1:16,则x值是
A.5 B.4 C.3 D.2
难度: 中等查看答案及解析
-
将浓度为0.1mol·L-1HF溶液加水不断稀释,下列各量始终保持增大的是
A.c(H+) B.Ka(HF) C.
D.
难度: 中等查看答案及解析
-
某组成为Al65Cu23Fe12的准晶体W具有低摩擦系数、高硬度、低表面能以及低传热性,正被开发为炒菜锅的镀层。下列有关说法中正确的是( )
A.W的熔点比铝、铁、铜的都高
B.将一定量W投入少量的盐酸中,充分反应后溶液中一定有Fe2+
C.W在氯气中完全燃烧时可形成AlCl3、FeCl3、CuCl2三种离子化合物
D.等质量的W分别与足量的NaOH溶液、盐酸反应,生成氢气的质量之比为65∶73
难度: 中等查看答案及解析
-
某实验小组模拟工业侯氏制碱法原理制备少量NaHCO3固体,将实验流程分为四个步骤。下列图示装置和操作能达到实验目的的是( )
A.制取氨气
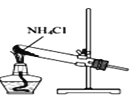
B.制取NaHCO3
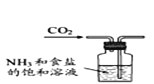
C.分离NaHCO3
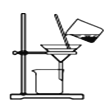
D.干燥NaHCO3
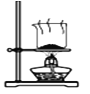
难度: 中等查看答案及解析
-
在密闭容器中发生反应: xA(g)+yB(s)
zC(g),平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断正确的是( )。
A.x+y>z B.平衡向正反应方向移动 C.B的转化率增大 D.C的体积分数下降
难度: 中等查看答案及解析
-
一定条件下向密闭容器中充入4molA和n molB,发生反应:2A(g)+3B(g)
4C(g)+6D(g),达平衡时测得A的转化率大于B,则n可能为( )
A.4 B.5 C.6 D.7
难度: 中等查看答案及解析
-
研究表明:三硫化四磷分子中没有不饱和键,且各原子的最外层均已达到了8电子的稳定结 构。在一个三硫化四磷分子中含有的共价键个数是( )
A.6 个 B.7 个 C.8 个 D.9 个
难度: 中等查看答案及解析
-
高锰酸钾在化工医药、水处理等很多方面有重要应用,可以用电解法制备,装置如下。直流电源采用乙烷—空气的碱性燃料电池。下列说法不正确的是(已知电流效率η=
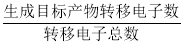 ×100%)
×100%)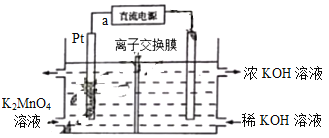
A. 电源负极的电极反应式为C2H6-14e-+18OH-=2CO32-+12H2O
B. 该离子交换膜为阴离子交换膜
C. a极为直流电源的正极
D. 若消耗0.02mo1
,产生0.055mol
,则
难度: 中等查看答案及解析
-
已知Fe2O3 (s)+3CO(g)
2Fe(s) +3CO2 (g),则反应达平衡后甲、乙两容器中说法不正确的是( )
起 始 量
温度T℃
平衡常数K=64
恒容且V=1L
Fe2O3
CO
Fe
CO2
甲
1 mol
1 mol
1 mol
1 mol
乙
1 mol
2 mol
1 mol
1mol
A.容器中混合气体的平均相对分子质量不变时反应达平衡
B.乙中CO2的体积分数为50%
C.甲中CO的转化率为60%
D.甲、乙两容器中 CO的体积分数相等
难度: 中等查看答案及解析
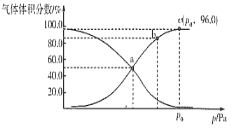
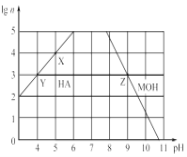
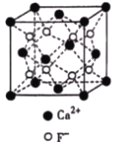
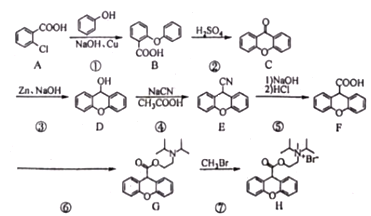
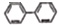 )结构,可与银氨溶液发生银镜反应,与
)结构,可与银氨溶液发生银镜反应,与