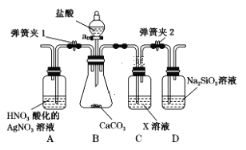
-
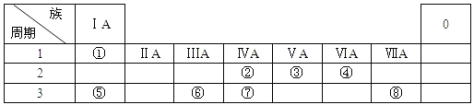
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-具有相同的电子层结构,下列关系正确的是( )
A. 质子数:c>b B. 离子的还原性:Y2->Z-
C. 氢化物的稳定性:H2Y>HZ D. 原子半径:X<W
难度: 中等查看答案及解析
-
氢化钠(NaH)是一种白色的离子化合物,其中钠元素是+1价;氢化钠与水反应生成H2和NaOH。下列叙述中,不正确的是( )
A. NaH的电子式为Na+[H]-
B. NaH中氢元素的离子的电子层排布与氦原子的电子层排布相同
C. 微粒半径H-<Li+
D. NaH与H2O反应时,水作氧化剂
难度: 中等查看答案及解析
-
下列各组性质的比较中正确的是( )
A. 酸性:HClO4<H2SO4<H3PO4 B. 碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2
C. 稳定性:HF>HCl>PH3>H2S D. 离子半径:Al3+>Mg2+>Na+
难度: 中等查看答案及解析
-
反应A(g)+3B(g)===2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·min-1
该反应进行的快慢顺序为( )
A. ② >④>③>① B. ④>②=③>①
C. ②=③>①>④ D. ② >③=④>①
难度: 中等查看答案及解析
-
银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn+H2O===2Ag+Zn(OH)2,下列说法中不正确的是
A. 原电池放电时,负极上发生反应的物质是Zn
B. 负极发生的反应是Zn+2OH−−2e−===Zn(OH)2
C. 工作时,负极区溶液c(OH−)减小
D. 溶液中OH−向正极移动,K+、H+向负极移动
难度: 中等查看答案及解析
-
下列物质中,只含有共价键的化合物是( )
A. NH4Cl B. O2 C. BaCl2 D. CO2
难度: 中等查看答案及解析
-
下列反应属于吸热反应的是( )
①液态水汽化 ②焦炭与水蒸气反应 ③浓硫酸稀释 ④氯化铵与氢氧化钡晶体反应 ⑤生石灰与水反应
A. ①④ B. ②③ C. ①④⑤ D. ②④
难度: 中等查看答案及解析
-
已知C+CO2
2CO为吸热反应,反应速度为v1;N2+3H2
2NH3为 放热反应,反应速度为v2。对于上述两个反应,当温度升高时,v1和v2的变化情况( )
A. 同时增大 B. 同时减小 C. v1增大,v2减小 D. v1减小,v2增大
难度: 中等查看答案及解析
-
化学科学需要借助化学专用语言描述,下列有关化学用语正确的是( )
A. CCl4的电子式:
B. Cl-的结构示意图:
C. CO2的电子式:
D. 质量数为37的氯原子:
难度: 中等查看答案及解析
-
10 ℃时,某化学反应速率为0.1mol/(L.s)若温度每升高10 ℃ ,反应速率增加到原来的2倍为了把该反应速率提高到1.6mol/(L.s),则该反 应所需的温度是( )
A. 30 ℃ B. 40 ℃
C. 50 ℃ D. 60 ℃
难度: 中等查看答案及解析
-
某元素阳离子Rn+,核外共有a个电子,原子的质量数为A,则mg该元素原子核里含有的中子的物质的量(mol)是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图表示N2(g)与O2(g)反应生成NO(g)过程中的能量变化:
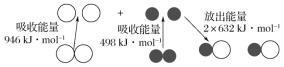
下列说法中正确的是( )
A. 1 mol N2(g)与1 mol O2(g)反应放出的能量为180 kJ
B. 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C. 通常情况下,N2(g)与O2(g)混合能直接生成NO(g)
D. NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
难度: 中等查看答案及解析
-
下列实验操作、现象与结论均正确的是( )
操作和现象
结论
A
将Na放入硫酸镁溶液中,有镁析出
钠比镁的金属性强
B
将Ba(OH)2·8H2O和NH4Cl晶体在小烧杯中混合搅拌,用手触摸烧杯外壁感觉变凉
Ba(OH)2·8H2O与NH4Cl反应是吸热反应
C
卤族元素最外层电子数都为7
最高正价都为正7价
D
向盛有H2O2溶液的两支试管中,分别加入少量MnO2粉末和FeCl3溶液,前者反应速率变得比后者快很多
只有MnO2可以加快H2O2分解的速率
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列装置可以构成原电池的是 ( )
A.
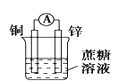
B.
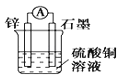
C.
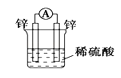
D.
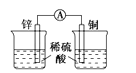
难度: 中等查看答案及解析
-
将等物质的量的A、B混合于2L的密闭容器中,发生下列反应:3A(g)+B(g)
xC(g)+2D(g),经2min后测得D的浓度为0.5mol·L-1,c(A)︰c(B)=3︰5, 以C表示的平均速率v(C)=0.25mol·L-1·min-1,下列说法不正确的是( )
A. 反应速率v(B)=0.125mol·L-1·min-1
B. 该反应方程式中,x=2
C. 2min时,C的物质的量为1.0mol
D. 2min时,A的浓度为1.5mol·L-1
难度: 中等查看答案及解析
-
在一定温度下,可逆反应2A(g)+3B(s)
2C(g)达到平衡的标志是( )
A. A、B、C的浓度相等
B. 气体平均摩尔质量不随时间改变而改变
C. A、B、C的分子数比为1∶3∶2
D. 气体的总物质的量不随时间改变而改变
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 熔化状态下能导电的化合物一定是离子化合物
B. 双原子分子中不一定含有非极性共价键
C. 只由非金属元素组成的化合物不一定是共价化合物
D. 不同元素组成的多原子分子里的化学键只存在极性键
难度: 中等查看答案及解析
-
研究人员研发了一种“水电池”,这种电池能利用淡水与海水之间含盐量的差别进行发电。在海水中,电池的总反应可表示为:5MnO2+2Ag+ 2NaCl==Na2Mn5O10+ 2AgCl,下列“水电池”在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl-+e-=AgCl
B. 每生成1 mol Na2Mn5O10转移4mol电子
C. Na+不断向“水电池”的负极移动
D. AgCl是氧化产物
难度: 中等查看答案及解析
-
等质量的两份锌粉a、b,分别加入过量的稀H2SO4中,同时向a中放入少量的CuSO4溶液,如图表示产生H2的体积(V)与时间(t)的关系,其中正确的是
A.
B.
C.
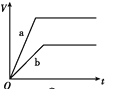 D.
D. 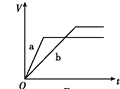
难度: 简单查看答案及解析
-
肼(H2N—NH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1 mol化学键所需的能量(kJ):N≡N键为942、O===O键为500、N—N键为154,则断裂1 mol N—H键所需的能量(kJ)是( )
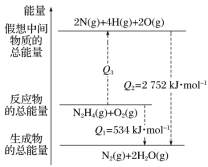
A. 194 B. 391 C. 516 D. 658
难度: 困难查看答案及解析