-
习近平总书记提出“绿水青山就是金山银山”的理念,下列行为不符合这一理念的是( )
A. 推广利用微生物发酵技术,将植物秸秆、动物粪便等制成沼气替代液化石油气
B. 加大石油、煤炭的开采速度,提高我国工业发展的速度
C. 发展水电,开发新能源,如核能、太阳能、电能等,减少对化石燃料的依赖
D. 实施绿化工程,防治扬尘污染
难度: 简单查看答案及解析
-
“西气东输”工程中输送的气体是
A.氢气 B.水煤气 C.天然气 D.液化气
难度: 简单查看答案及解析
-
化学与生活密切相关。下列说法错误的是
A.用灼烧的方法可以区分蚕丝和人造纤维
B.食用油反复加热会产生稠环芳香烃等有害物质
C.福尔马林可用来浸制标本,因其可使蛋白质变性
D.医用消毒酒精中乙醇的浓度为95%
难度: 中等查看答案及解析
-
下列有关有机物的说法中正确的是( )
A.
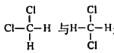 是同分异构体
是同分异构体B.乙醇、乙酸、乙烷都能发生取代反应
C.乙烯能使溴水和酸性KMnO4溶液褪色,且反应类型相同
D.相同质量的CH4、C2H4、苯完全燃烧,耗氧量最小的是CH4
难度: 简单查看答案及解析
-
下列图示变化为吸热反应的是( )
A.
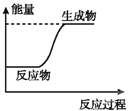 B.
B. 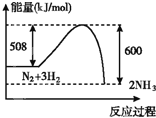
C.
 D.
D. 
难度: 中等查看答案及解析
-
误食重金属盐会引起中毒,可用于急救解毒的方法有( )
A. 服用大量开水 B. 服用足量的牛奶
C. 服用足量的酒精 D. 服用足量的硫酸钠
难度: 简单查看答案及解析
-
在A(g)+B(g)=C(g)+2D(g)反应中,下列表示的反应速率最快的是
A.υ(A)=0.1mol• L-1 • min-1 B.υ(B)= 0.2mol• L-1 • min-1
C.υ(C)= 0.3mol• L-1 • min-1 D.υ(D)= 0.4mol• L-1 • min-1
难度: 简单查看答案及解析
-
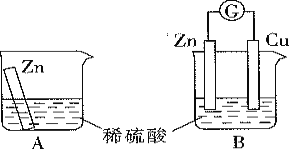
下列装置中,能构成原电池的是( )
A.
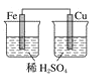 B.
B. 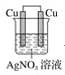 C.
C. 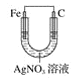 D.
D. 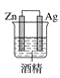
难度: 简单查看答案及解析
-
下列金属防腐的措施中,属于牺牲阳极的阴极保护法的是 ( )
A.水中的钢闸门连接电源的负极
B.地下钢管连接锌板
C.铁件镀铜
D.自行车的钢圈和车铃上镀上一层铬,既耐腐蚀又美观耐磨
难度: 简单查看答案及解析
-
暖宝宝贴有散热均衡、发热持久、直接撕开外包装便可发热等优点,它能保持51~60℃约12个小时,它采用铁的“氧化放热”原理,利用微孔透氧的技术,采用完全隔绝空气的方式,使其发生原电池反应,铁粉在原电池中( )

原材料名:铁粉、水、活性炭、蛭石、食盐
A. 作正极 B. 得到电子 C. 被还原 D. 作负极
难度: 简单查看答案及解析
-
下列说法正确的是
A.煤、石油均为纯净物 B.石油的裂化、裂解都是化学变化
C.糖类物质均能发生水解反应 D.油脂、蛋白质均为高分子化合物
难度: 简单查看答案及解析
-
下列各反应中属于加成反应的是( )
A.H2+Cl2
2HCl
B.CH2=CH2+3O2
2CO2+2H2O
C.CH2=CH2+H2O
CH3CH2OH
D.CH3—CH3+2Cl2
CH2Cl—CH2Cl+2HCl
难度: 中等查看答案及解析
-
在2 L的密闭容器中,发生以下反应:2A(g)+B(g)
2C(g)+D(g),若最初加入的A和B都是4 mol,在前10 s A的平均反应速率为0.12 mol/(L·s),则10 s时,容器中B的物质的量是( )
A.3.4 mol B.3.2 mol C.2.8 mol D.1.2 mol
难度: 简单查看答案及解析
-
下列关于化学反应速率的说法正确的是 ( )
A. 化学反应速率是指单位时间内任何一种反应物物质的量的减少或任何一种生成物物质的量的增加
B. 化学反应速率为0.8 mol/(L·s)是指1s 时某物质的浓度为0.8mol/L
C. 根据化学反应速率的大小可以知道化学反应进行的快慢
D. 决定反应速率的主要因素是反应物的浓度
难度: 简单查看答案及解析
-
下列关于铜电极的叙述不正确的是
A. 铜锌原电池中铜是正极
B. 用电解法精炼粗铜时粗铜作阳极
C. 在镀件上电镀铜时,用金属铜作阳极
D. 电解稀硫酸制H2、O2时铜作阳极
难度: 中等查看答案及解析
-
下列有关电解池的说法正确的是( )
A.在电解池中与外接电源负极相连的电极是阳极
B.电解任何物质阳极上失电子数与阴极上得电子数相等
C.电解氯化铜溶液时在阴极上有气体生成
D.电解NaCl、CuCl2两种溶液参加反应的物质是相同的
难度: 中等查看答案及解析