-
下列物质中,属可再生能源的是
A、乙醇 B、石油 C、煤 D、天然气
难度: 简单查看答案及解析
-
下列反应中,生成物的总能量大于反应物总能量的是
A.氢气在氧气中燃烧 B.氢气与氯气化合
C.中和反应 D.焦炭在高温下与水蒸气反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.需要加热才能发生的反应一定是吸热反应
B.化学反应中的能量变化都表现为热量变化
C.任何放热反应在常温下一定能发生反应
D.反应物和生成物所具有的总能量决定了反应是放热还是吸热
难度: 中等查看答案及解析
-
已知在1×105Pa,298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+242kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1
C.H2(g)+1/2O2(g)=H2O(g) ΔH=+242kJ·mol-1
D.2H2(g)+O2(g)=2H2O(g) ΔH=+484kJ·mol-1
难度: 中等查看答案及解析
-
已知下列热化学方程式:
Zn(s)+1/2O2(g)===ZnO(s) ΔH1=-351.1 kJ/mol
Hg(l)+1/2O2(g)===HgO(s) ΔH2=-90.7 kJ/mol
由此可知Zn(s)+HgO(s)===ZnO(s)+Hg(l) ΔH3,其中ΔH3是
A.-441.8 kJ/mol B.-254.6 kJ/mol
C.-438.9 kJ/mol D.-260.4 kJ/mol
难度: 简单查看答案及解析
-
对已达化学平衡的下列反应 2X(g)+Y(g)
2Z(g)减小压强时,对反应产生的影响是
A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动
B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动
C.正、逆反应速率都减小,平衡向逆反应方向移动
D.正、逆反应速率都增大,平衡向正反应方向移动
难度: 简单查看答案及解析
-
已知反应X+Y= M+N为放热反应,对该反应的下列说法中正确的
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
难度: 简单查看答案及解析
-
下列化合物属于弱电解质的是
A. HClO4 B. Ba(OH)2 C. CO2 D. HF
难度: 简单查看答案及解析
-
有一化学平衡:mA(g)+nB(g)
pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
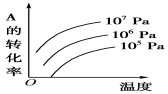
A.正反应吸热:m+n>p+q
B.正反应吸热:m+n<p+q
C.正反应放热:m+n>p+q
D.正反应放热:m+n<p+q
难度: 中等查看答案及解析
-
对于反应2SO2(g)+O2(g)
2SO3(g),能增大正反应速率的措施是
A.通入大量O2 B.增大容器容积
C.移去部分SO2 D.降低体系温度
难度: 简单查看答案及解析
-
水的三态的熵值的大小关系正确的是(Sm表示1 mol物质的熵值)
A.Sm(s)>Sm(l)>Sm(g) B.Sm(l)>Sm(s)>Sm(g)
C.Sm(g)>Sm(l)>Sm(s) D.Sm(s)=Sm(l)=Sm(g)
难度: 简单查看答案及解析
-
在2A+B
3C+4D反应中,表示该反应速率最快的是
A.υ(A)= 0.5 mol/(L·s) B.υ(B)= 0.3 mol/(L·s)
C.υ(C)= 0.8 mol/(L·s) D.υ(D)= 1 mol/(L·s)
难度: 简单查看答案及解析
-
一定条件下反应2AB(g)
A2(g)+B2(g)达到平衡状态的标志是
A.单位时间内生成nmolA2,同时消耗2n molAB
B.容器内,3种气体AB、A2、B2共存
C.AB的消耗速率等于A2的消耗速率
D.容器中各组分的体积分数不随时间变化
难度: 中等查看答案及解析
-
在一密闭容积的容器中进行反应:2SO2(g)+O2(g)
2SO3(g)。已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2 mol•L-1、0.1 mol•L-1、0.2 mol•L-1。当反应达平衡时,可能存在的数据是
A. SO2为0.4 mol•L-1,O2为0.2 mol•L-1
B. SO2为0.25 mol•L-1
C. SO2、SO3均为0.15 mol•L-1
D. SO3为0.4 mol•L-1
难度: 简单查看答案及解析
-
某温度下,反应SO2(g)+ O2(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
2SO2(g) + O2(g)的平衡常数K2的值为
A. 2500 B. 100 C. 4×10-4 D. 2×10-2
难度: 简单查看答案及解析
-
室温下,把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于
A. 1×10-4 mol/L B. 1×10-8 mol/L C. 1×10-11 mol/L D. 1×10-10 mol/L
难度: 简单查看答案及解析
-
下列事实能说明亚硝酸是弱电解质的是
A.NaNO2溶液的pH大于7 B.用HNO2溶液作导电试验,灯泡很暗
C.HNO2不跟NaCl反应 D.可以使石蕊试剂变色
难度: 简单查看答案及解析
-
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH
CH3COO-+H+,要使溶液中c(H+)/ c(CH3COOH)值增大,可以采取的措施是
①加少量烧碱固体 ②升高温度 ③加少量冰醋酸 ④加水
A.①② B.②③ C.③④ D.②④
难度: 简单查看答案及解析
-
相同条件下,等体积、等pH的醋酸溶液和盐酸分别加水稀释后,溶液的pH仍相同,则所得溶液的体积
A.仍相同 B.醋酸大 C.盐酸大 D.无法判断
难度: 简单查看答案及解析
-
下列叙述正确的是
A.95 ℃纯水的pH<7,说明加热可导致水呈酸性
B.pH = 3的醋酸溶液,稀释至10倍后pH = 4
C.0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
D.pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
难度: 简单查看答案及解析